肝细胞癌(HCC)细胞分泌的外泌体(exo)能刺激M2巨噬细胞极化,促进HCC进展,但lncRNA DLX6-AS1与HCC外源介导的M2巨噬细胞极化的相关机制在很大程度上是不明确的。这项研究通过M2巨噬细胞极化和miR-15a-5p/ CXCL17轴揭示DLX6-AS1在HCC HCC-exo中的作用。本文于2021年5月发表在《Journal of Experimental & Clinical Cancer Research》IF:7.068期刊上。
技术路线:

主要实验结果:
1、HCC-exo诱导巨噬细胞M2极化
外泌体分离自SMMC-7721肝癌细胞系,经由电镜和WB进行鉴定(Fig. 1a-b)。巨噬细胞选择的是TPH-1,使用PMA诱导该细胞发展为巨噬细胞(Fig. 1c)。随后将PKH-26标记的外泌体与巨噬细胞共培养,结果显示外泌体被巨噬细胞内化(Fig. 1d)。M2巨噬细胞标志物,CD206,CD163,CCL17,CCL18在外泌体共孵育组显著增加,而M1巨噬细胞标志物,TNF-α,IL-6,TGF-β,则没有明显改变(Fig.1e,f)。这些结果表明HCC-exo诱导巨噬细胞M2极化。
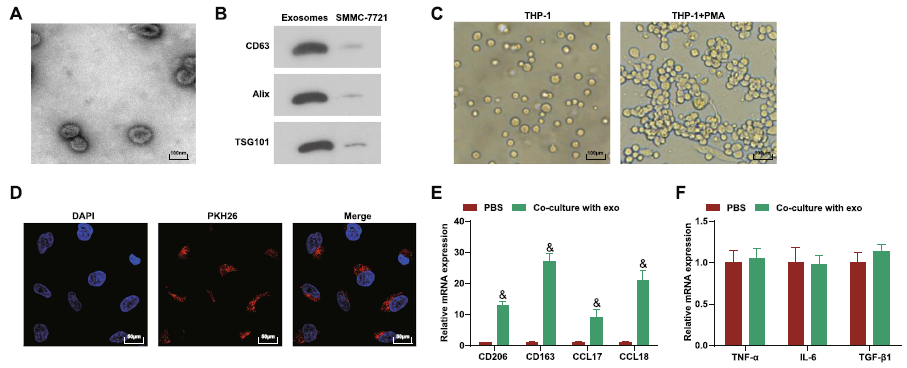
图1 HCC-exo诱导巨噬细胞M2极化
2、HCC-exo通过诱导M2巨噬细胞极化促进迁移、侵袭和EMT
将HCC-exo处理过的M2巨噬细胞与SMMC-7721共培养,结果发现其迁移和侵袭能力增强,EMT进程加速。
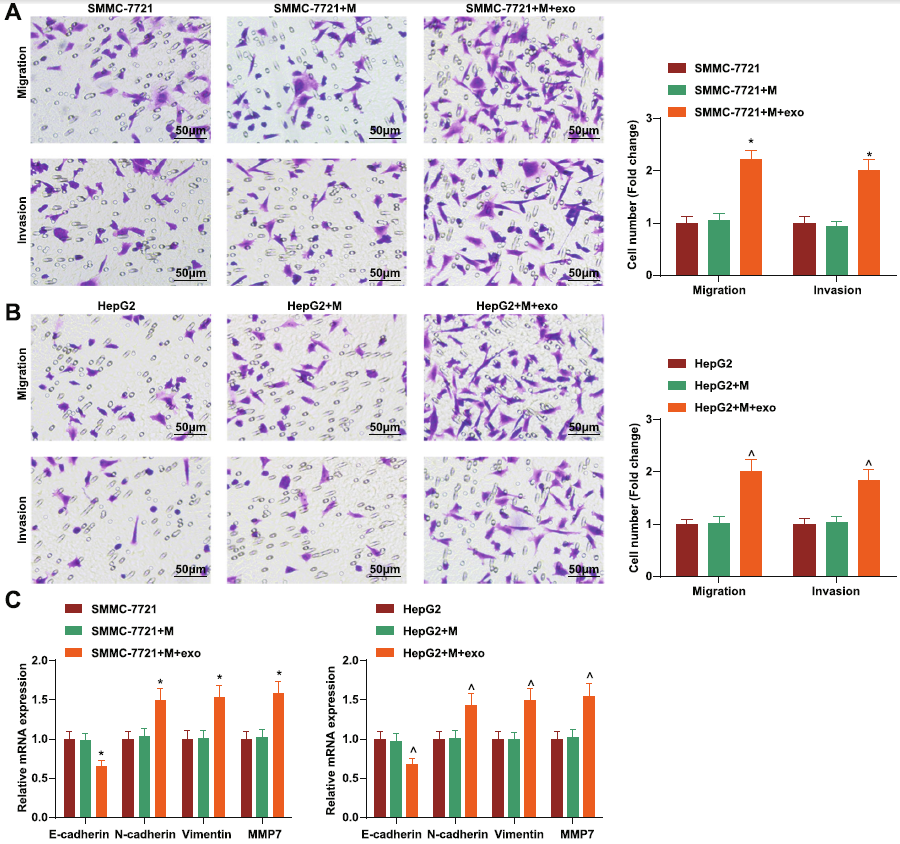
图2 HCC-exo通过诱导M2巨噬细胞极化促进迁移、侵袭和EMT
3、DLX6-AS1在HCC中过表达并触发迁移、侵袭和EMT
HCC中高表达的DLX6-AS1能促进肿瘤生长。作者研究发现DLX6-AS1在癌症组织和SMMC-7721和HepG2中高表达。随后,在这两个细胞系中构建DLX6-AS1的过表达。结果显示,为了响应DLX6-AS1的过表达,两种细胞系的迁移、侵袭和EMT都显著提高。
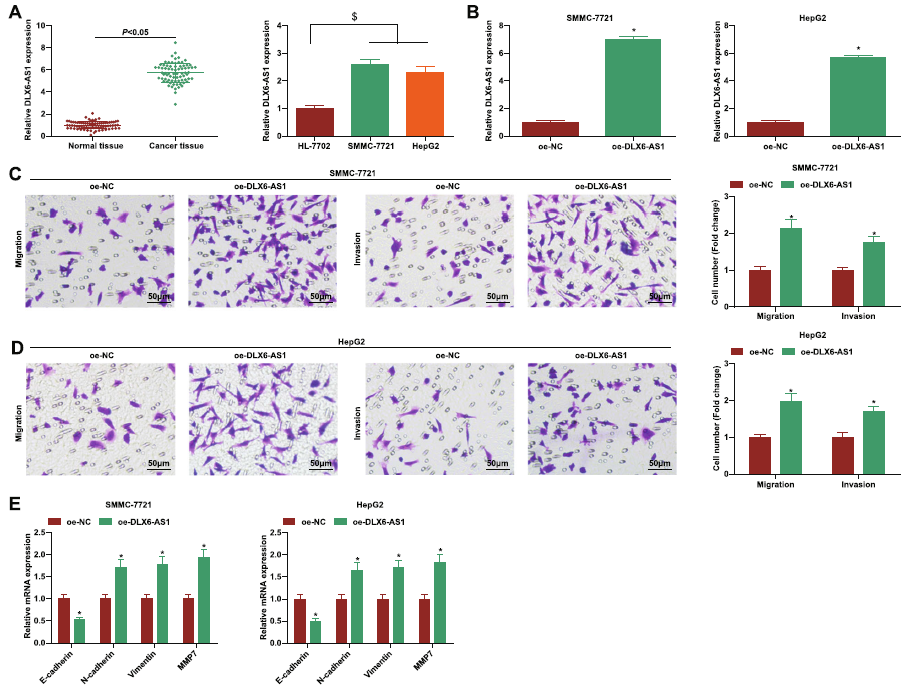
图3 DLX6-AS1在HCC中过表达并触发迁移、侵袭和EMT
4、HCC-exo来源DLX6-AS1刺激M2巨噬细胞极化加速迁移、侵袭和EMT
作者检测了HCC患者和健康对照的血浆来源的外泌体中DLX6-AS1的表达,结果发现,DLX6-AS1在HCC外泌体中显著高表达。此外,巨噬细胞在HCC肿瘤组织中的分布显著高于对照,并且其分布于DLX6-AS1的表达正相关(Fig.4b, c)。提示DLX6-AS1可能参与了HCC-exo介导巨噬细胞M2极化的过程。随后,构建oe-DLX6-AS1,sh-DLX6-AS1和NC的HCC-exo。结果和预期相符,HCC-EXO中DLX6-AS1的表达在oe组上调,在sh组下调 (Fig.4d, 5a)。然后,将携带oe-DLX6-AS1,sh-DLX6-AS1的HCC-exo与巨噬细胞共培养,结果发现DLX6-AS1在巨噬细胞中的表达具有时间依赖性(Fig.4e, 5b),证实DLX6-AS1可以被外泌体传输。随后检测两组中M1和M2的标志物的表达情况,结果显示,与sh-DLX6-AS1相比,oe-DLX6-AS1组M2标志物上调表达,M1标志物物差别,并且用携带oe-DLX6-AS1外泌体处理过的巨噬细胞孵育SMMC-7721和HepG2细胞后,其迁移,侵袭和EMT显著提高。以上表明HCC-exo来源DLX6-AS1刺激M2巨噬细胞极化加速迁移、侵袭和EMT。
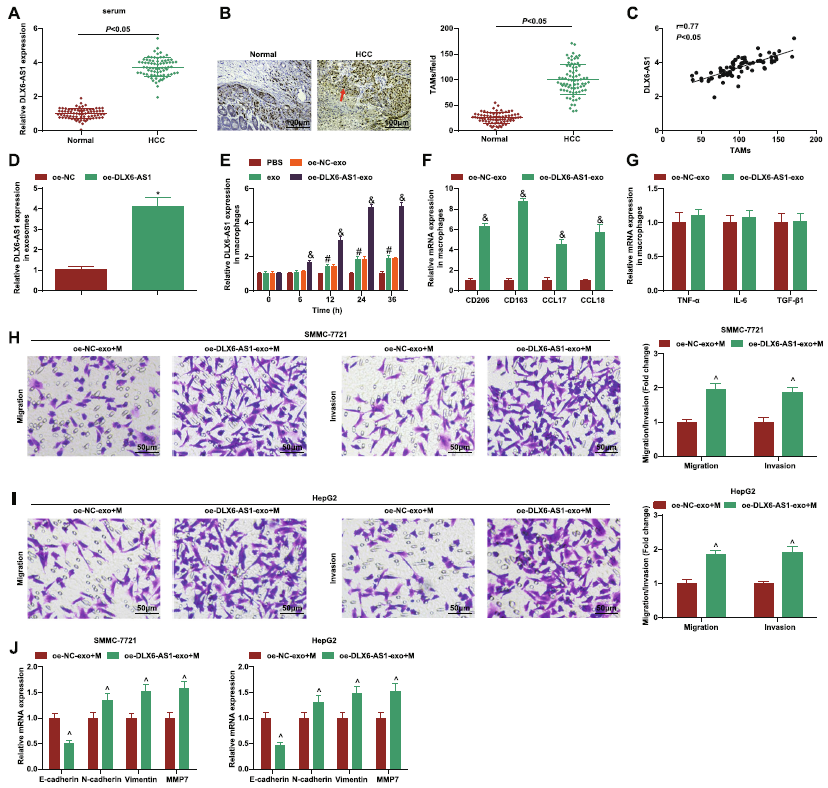
图4 HCC-exo中DLX6-AS1刺激M2巨噬细胞极化加速迁移、侵袭和EMT
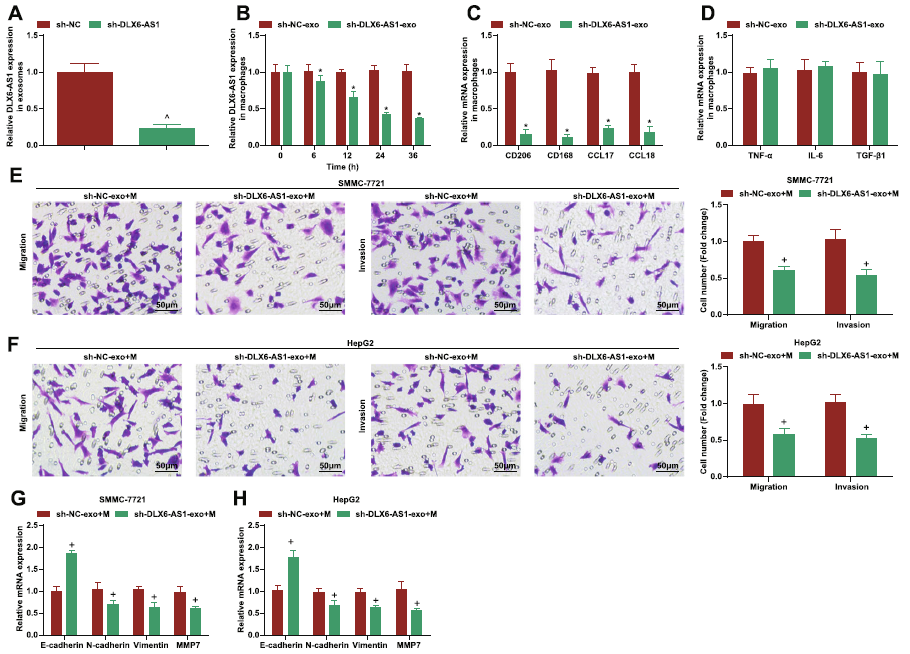
图5 HCC-exo中DLX6-AS1刺激M2巨噬细胞极化加速迁移、侵袭和EMT
5、DLX6-AS1与miR-15a-5p相互作用
文献报道 miR-15a-5p是一种新的肿瘤标志物,在多种癌症中下调。作者检测发现miR-15a-5p在HCC肿瘤组织和细胞系中均显著下调,并且在HCC-exo处理的巨噬细胞中表达抑制。因此,探究了DLX6-AS1与miR-15a-5p相互作用。荧光素酶实验,AGO2-RIP实验和RNA pull-down实验证实了其作用关系。
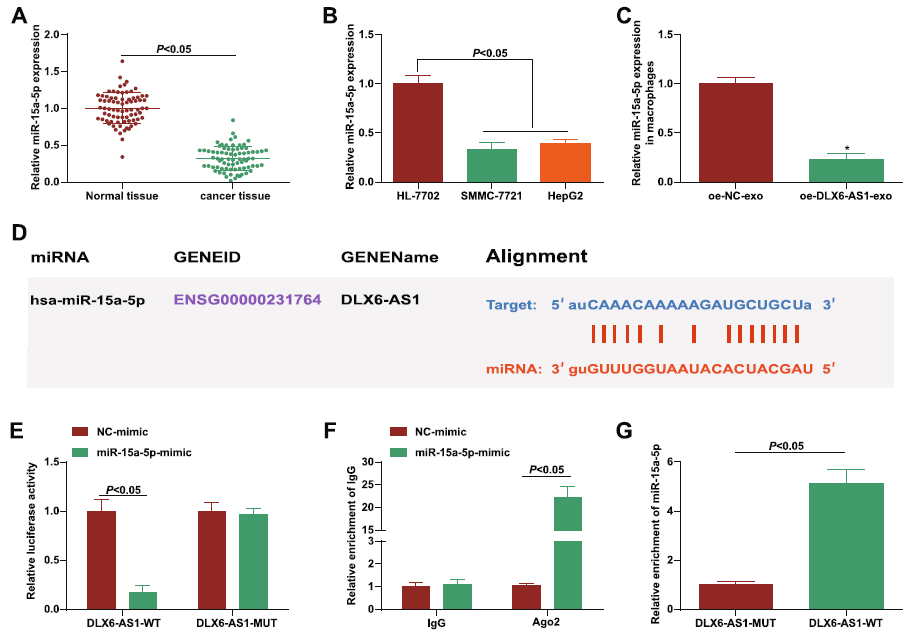
图6 DLX6-AS1与miR-15a-5p相互作用
不仅如此,巨噬细胞中也发现了miR-15a-5p的表达抑制,重要的是,抑制miR-15a-5p表达可以促进巨噬细胞M2极化,并进一步促进肿瘤细胞的侵袭,迁移和EMT(图7)。
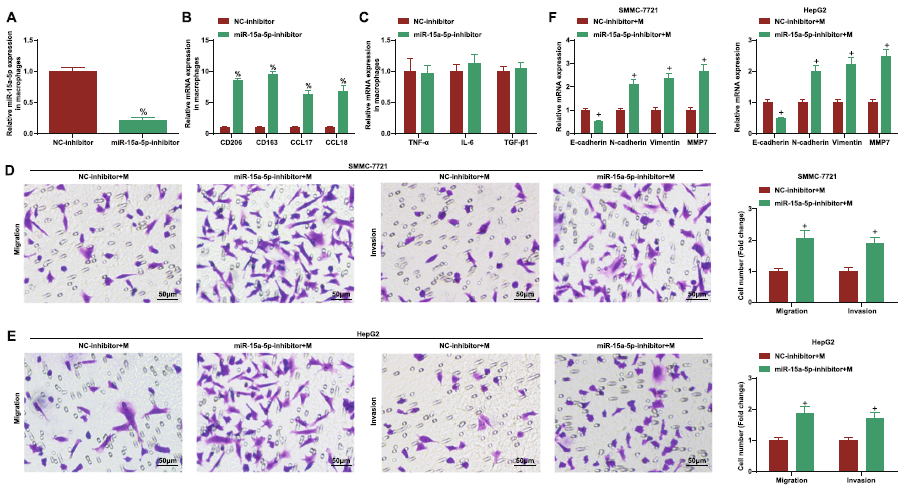
图7下调miR-15a-5p促进M2巨噬细胞极化和HCC细胞迁移、侵袭和EMT
6、在HCC中DLX6-AS1介导miR-15a-5p靶向CXCL17驱动迁移、侵袭和EMT
据文献报道,CXCL17在HCC中高表达,与不良预后有关,该结果也在本文中得到证实(Fig. 8a, b)。随后,作者还发现miR-15a-5p与CXCL17之间存在靶向关系(Fig. 8c)。
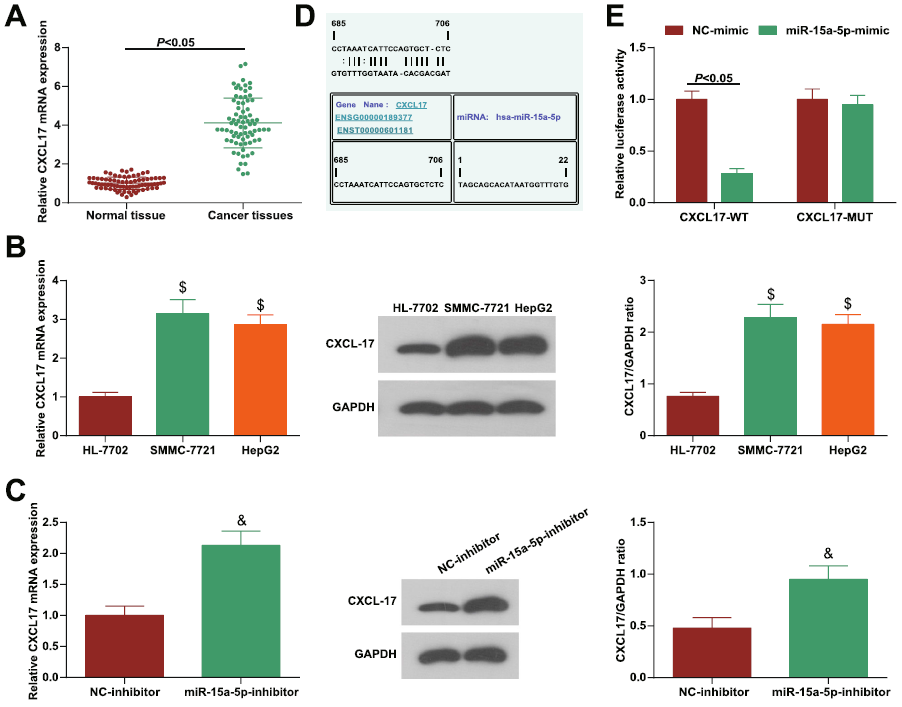
图8在HCC中DLX6-AS1介导miR-15a-5p靶向CXCL17驱动迁移、侵袭和EMT
鉴于文献记载CXCL17驱动巨噬细胞极化的事实,作者推测它可能也参与了DLX6-AS1/miR-15a-5p轴介导的巨噬细胞M2极化在HCC转移过程中。图9表明,沉默CXCL17导致巨噬细胞M2极化受到抑制,并且CXCL17沉默也能显著降低oe-DLX6-AS1带来的巨噬细胞M2极化。进一步地,沉默CXCL17对HCC细胞迁移、侵袭和EMT的抑制作用也得到证实。这些结果表明在HCC中,DLX6-AS1介导miR-15a-5p靶向CXCL17驱动迁移、侵袭和EMT。
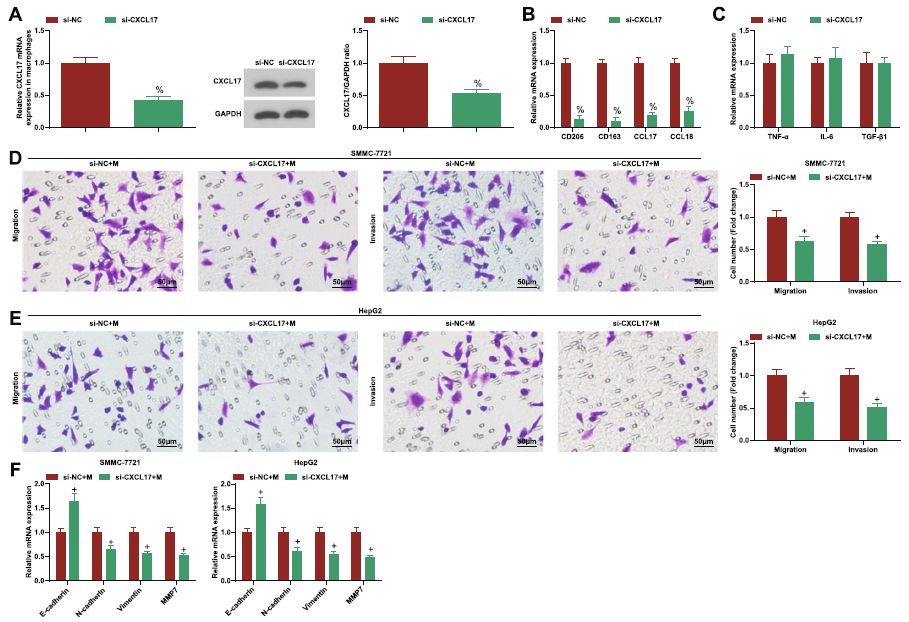
图9 DLX6-AS1介导miR-15a-5p靶向CXCL17驱动迁移、侵袭和EMT
7、HCC-exo的DLX6-AS1通过诱导M2巨噬细胞在HCC小鼠中促进肺转移
最后,作者在小鼠体内验证上述结果,结果显示,与PBS对照组相比,外泌体孵育的巨噬细胞组肿瘤转移结节显著升高,而过表达DLX6-AS1能进一步扩大转移的影响。

图10 HCC-exo的DLX6-AS1通过诱导M2巨噬细胞在HCC小鼠中促进肺转移
参考文献:
Wang Lin-Pei., Lin Jing., Ma Xiao-Qiu., Xu Dong-Yao., Shi Chun-Feng., Wang Wei., Jiang Xiao-Jie.(2021). Exosomal DLX6-AS1 from hepatocellular carcinoma cells induces M2 macrophage polarization to promote migration and invasion in hepatocellular carcinoma through microRNA-15a-5p/CXCL17 axis. J Exp Clin Cancer Res, 40(1), 177. doi:10.1186/s13046-021-01973-z




评论