课程时间:2016年6月29日-7月1日
课程地点:南京高新区星火北路20号南京生物医药谷发展中心1楼报告厅
课程特色:
l 根据课程需要,认真遴选相关领域的知名专家担任授课讲师!
l 所有讲师根据专家组的命题,重新思索整理后的知识和经验的分享!
l 所有讲义均经讲师认真修改,很多知识点是首次公开!
l 食药监注册处超级实用的现场核查要点解读!
l 从实际出发,分别从政策解读、溶出曲线剖析、处方工艺研究、杂质谱和质量标准研究、BE试验监管等多个角度,深入细致的讲解仿制药一致性评价的操作过程!
课程疑难解答:
● 国外一致性评价的特点以及对我们的启示。
● 现场核查专家的关注点有哪些?
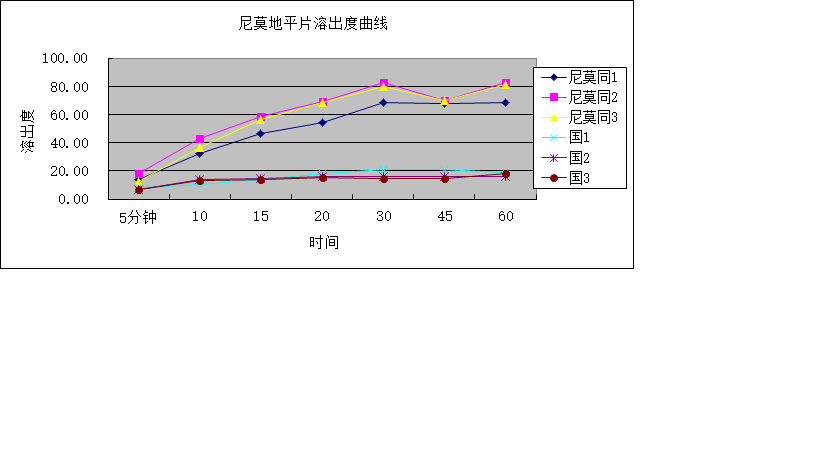
● 如何得到具有区分力的溶出曲线?
● 处方二次开发的关键工艺参数在哪里?
● 如何比对杂质谱,制订合理的质量标准?
● 如何监管 BE 试验,保证数据真实性,提高 BE 试验成功率?
部分讲师介绍:
周立春简介
1983年参加工作,从事药物分析、新药的研发以及药品检验工作三十余年,历任北京药检所化学室、生化室、抗生素室主任,所
长助理;为第九、十届国家药典委员;国家药品审评中心的客座专家;国家及北京市审评专家库专家;国家及北京市科技奖评选专家;国家药品审评中心的立卷审查小组成员。
尹莉芳简介
尹莉芳,女,教授,博士(中国药科大学),博士生导师,中国药科大学药学院副院长,教育部新世纪优秀人才,国家发改委药品价格评审专家,科技部国际合作同行专家,国家食品药品监督管理局审评中心审评专家,江苏省333新世纪科学技术带头人培养工程(简称“333工程”)第三层次培养对象、南京市突出贡献中青年专家。主持了数十个横向和纵向课题,产业化经验丰富,获得20余个新药证书或者临床批件。以第一发明人申请发明专利36项,获得授权7项,专利权转让3项。参编药剂学等教材,发表SCI等学术论文60余篇。
陆步实简介
江苏省药物研究所所长助理,药品质量一致性评价研究中心主任,研究员,南京工业大学硕士生导师,江苏省科技厅新药项目评审专家库成员,江苏省高等学校医药教育研究会理事。先后主持新药开发项目30多项,获得新药证书和临床批件20多份,专利3份。参与国家自然科学基金、国家新药创制重大专项、省科技厅、省卫生厅科技项目多项,发表论文20多篇。在长期的药学科研工作中,在制剂学特别是缓控释制剂方面积累了丰富的经验。
徐坚简介
现任上海臣邦医药科技有限公司研发总监、首席科学家。
1982年毕业于中国药科大学,药学博士。曾任中国药科大学药剂学副教授、研究生导师,江苏省药剂专业委员会秘书。
1997年在英国Ivax制药公司进行合作研究,2000年4月至2002年4月作为高级访问学者在新西兰Otago大学从事药剂学研究工作。
2002年4月至2007年4月,在新西兰Ancare制药公司任资深科学家和制剂研发主管,并任奥克兰大学研究员。
2007年5月加盟以岭医药集团任首席专家、研究院副院长,主持多项重大研究。作为项目主持,申请到国家发改委专项资助资金一千万元。
2009年4月加盟江苏恒瑞医药股份有限公司,任首席科学家、国外仿制药研究所所长、制剂新技术研究所所长。
2014年4月加盟上海臣邦医药科技有限公司任研发总监、首席科学家。
曾参编4本专著,发表研究论文10多篇,取得多项重大科研成果,申请多项国内外专利并获授权,带领团队在国内外申报20多个品种并获批。为江苏省双创领军人才。
张天谊(Tee)简介
方达医药(中国)总经理,美国方达医药高级副总裁
2001年美国佛罗里达大学获分析化学博士,2009年美国弗吉尼亚联邦大学获工商管理硕士。
在医药研发,生物分析及质量控制领域具有二十年的工作经验,曾在多家美国CRO公司( BASi, Tandem Labs, PPD,MPIResearch等)从事实验室管理和研究工作,先后担任过高级研究员、研发经理和运营总监等职务。
现任美国方达医药高级副总裁和中国方达总经理,多年来发表了六十多篇科学论文;研究领域涉及药物代谢机理、GLP规范化生物分析、临床试验和结果解析、磷脂基质效应、系统化LC/MS/MS方法建立和问题处理,研究出了很多富有挑战性的生物分析方法(其中包括测定不稳定的药物和核苷酸、抗体、多肽和蛋白质等大分子药物等),还在GLP实验室管理和程序优化以提供高品质和规范化生物分析服务等方面具有丰富的经验,已为国内外数十家从事医药国际化的公司提供过生物分析测试服务。目前方达上海实验室已成为国内第一家多次通过美国FDA现场核查的支持新药和仿制药国际申报的生物分析实验室。
课程安排:
受场地条件限制,本次培训采取限额报名,额满即止。(以汇款时间为准)
报名费用:
报名费用:包含参会费、培训资料、6.30-7.1的午餐各一顿、茶歇数次(差旅交通、住宿、早餐晚餐需自理)
报名方式:
1、填写报名回执并发送邮件至meeting@biopharmpt.com
2、添加微信公众号:NJ_Biopharmpt,如您通过微信收到关于本次培训的报名通知,则可通过手机端完成报名
3、QQ咨询:1450592620
4、电话报名:025-86905305
通过QQ或微信报名成功,即可获得100元减免金!
南京高新生物医药公共服务平台
Nanjing Biopharmaceutical Innovation Platform Co. Ltd (BIP)
课程地点:南京高新区星火北路20号南京生物医药谷发展中心1楼报告厅
课程特色:
l 根据课程需要,认真遴选相关领域的知名专家担任授课讲师!
l 所有讲师根据专家组的命题,重新思索整理后的知识和经验的分享!
l 所有讲义均经讲师认真修改,很多知识点是首次公开!
l 食药监注册处超级实用的现场核查要点解读!
l 从实际出发,分别从政策解读、溶出曲线剖析、处方工艺研究、杂质谱和质量标准研究、BE试验监管等多个角度,深入细致的讲解仿制药一致性评价的操作过程!
课程疑难解答:
● 国外一致性评价的特点以及对我们的启示。
● 现场核查专家的关注点有哪些?
● 如何得到具有区分力的溶出曲线?
● 处方二次开发的关键工艺参数在哪里?
● 如何比对杂质谱,制订合理的质量标准?
● 如何监管 BE 试验,保证数据真实性,提高 BE 试验成功率?
部分讲师介绍:
周立春简介
1983年参加工作,从事药物分析、新药的研发以及药品检验工作三十余年,历任北京药检所化学室、生化室、抗生素室主任,所
长助理;为第九、十届国家药典委员;国家药品审评中心的客座专家;国家及北京市审评专家库专家;国家及北京市科技奖评选专家;国家药品审评中心的立卷审查小组成员。
尹莉芳简介
尹莉芳,女,教授,博士(中国药科大学),博士生导师,中国药科大学药学院副院长,教育部新世纪优秀人才,国家发改委药品价格评审专家,科技部国际合作同行专家,国家食品药品监督管理局审评中心审评专家,江苏省333新世纪科学技术带头人培养工程(简称“333工程”)第三层次培养对象、南京市突出贡献中青年专家。主持了数十个横向和纵向课题,产业化经验丰富,获得20余个新药证书或者临床批件。以第一发明人申请发明专利36项,获得授权7项,专利权转让3项。参编药剂学等教材,发表SCI等学术论文60余篇。
陆步实简介
江苏省药物研究所所长助理,药品质量一致性评价研究中心主任,研究员,南京工业大学硕士生导师,江苏省科技厅新药项目评审专家库成员,江苏省高等学校医药教育研究会理事。先后主持新药开发项目30多项,获得新药证书和临床批件20多份,专利3份。参与国家自然科学基金、国家新药创制重大专项、省科技厅、省卫生厅科技项目多项,发表论文20多篇。在长期的药学科研工作中,在制剂学特别是缓控释制剂方面积累了丰富的经验。
徐坚简介
现任上海臣邦医药科技有限公司研发总监、首席科学家。
1982年毕业于中国药科大学,药学博士。曾任中国药科大学药剂学副教授、研究生导师,江苏省药剂专业委员会秘书。
1997年在英国Ivax制药公司进行合作研究,2000年4月至2002年4月作为高级访问学者在新西兰Otago大学从事药剂学研究工作。
2002年4月至2007年4月,在新西兰Ancare制药公司任资深科学家和制剂研发主管,并任奥克兰大学研究员。
2007年5月加盟以岭医药集团任首席专家、研究院副院长,主持多项重大研究。作为项目主持,申请到国家发改委专项资助资金一千万元。
2009年4月加盟江苏恒瑞医药股份有限公司,任首席科学家、国外仿制药研究所所长、制剂新技术研究所所长。
2014年4月加盟上海臣邦医药科技有限公司任研发总监、首席科学家。
曾参编4本专著,发表研究论文10多篇,取得多项重大科研成果,申请多项国内外专利并获授权,带领团队在国内外申报20多个品种并获批。为江苏省双创领军人才。
张天谊(Tee)简介
方达医药(中国)总经理,美国方达医药高级副总裁
2001年美国佛罗里达大学获分析化学博士,2009年美国弗吉尼亚联邦大学获工商管理硕士。
在医药研发,生物分析及质量控制领域具有二十年的工作经验,曾在多家美国CRO公司( BASi, Tandem Labs, PPD,MPIResearch等)从事实验室管理和研究工作,先后担任过高级研究员、研发经理和运营总监等职务。
现任美国方达医药高级副总裁和中国方达总经理,多年来发表了六十多篇科学论文;研究领域涉及药物代谢机理、GLP规范化生物分析、临床试验和结果解析、磷脂基质效应、系统化LC/MS/MS方法建立和问题处理,研究出了很多富有挑战性的生物分析方法(其中包括测定不稳定的药物和核苷酸、抗体、多肽和蛋白质等大分子药物等),还在GLP实验室管理和程序优化以提供高品质和规范化生物分析服务等方面具有丰富的经验,已为国内外数十家从事医药国际化的公司提供过生物分析测试服务。目前方达上海实验室已成为国内第一家多次通过美国FDA现场核查的支持新药和仿制药国际申报的生物分析实验室。
课程安排:
| 6月29日(周三) | 内容 | |
| 9:00-17:00 | 签到、发培训材料、领取发票 | |
| 6月30日(周四) | 内容 | 演讲人 |
| 8:45 | 进场 | |
| 9:00 | 开幕式 | 南京高新区领导 |
| 9:30-10:30 | 中美仿制药一致性评价比较 | 徐坚博士,上海臣邦医药科技有限公司研发总监、首席科学家 |
| 10:30-10:45 | 茶歇 | |
| 10:45-11:45 | 现场核查要点解读 | 江苏省食品药品监督管理局药品注册管理处专家老师 |
| 11:45-12:15 | 赞助商宣讲 | |
| 12:15-14:00 | 午餐午休 | |
| 14:00-15:00 | 科学研究溶出曲线 | 陆步实研究员,江苏省药物研究所所长助理,药物质量一致性评价研究中心主任 |
| 15:00-15:15 | 茶歇 | |
| 15:15-17:00 | 仿制药研发的处方筛选和关键工艺参数研究 | 尹莉芳博士,中国药科大学教授,博士生导师,教育部新世纪优秀人才,国家发改委药品价格评审专家,科技部国际合作同行专家,国家食品药品监督管理局审评中心审评专家 |
| 17:00-17:30 | 赞助商宣讲 | |
| 7月1日(周五) | 内容 | 演讲人 |
| 9:00-10:30 | 中日仿制药一致性评价比较 | 周立春主任,北京药检所所长助理,国家局新药审评专家库专家,仿制药立卷审查研究小组成员,北京市药监局新药研制现场核查资深专家,国家药典委员会化学专业委员会委员 |
| 10:30-10:45 | 茶歇 | |
| 10:45-11:45 | 制剂杂质谱分析和有关物质的研究 | 周立春主任,北京药检所所长助理,国家局新药审评专家库专家,仿制药立卷审查研究小组成员,北京市药监局新药研制现场核查资深专家,国家药典委员会化学专业委员会委员 |
| 11:45-12:15 | 赞助商宣讲 | |
| 12:15-14:00 | 午餐午休 | |
| 14:00-15:30 | 从CRO角度BE实验研究中注意事项 | 张天谊博士,泰格医药方达(中国)总经理,美国方达医药高级副总裁 |
| 15:30-16:00 | 赞助商宣讲 | |
| 16:00-17:00 | 圆桌讨论会 | 与专家互动交流、现场答疑、学员问题汇总 |
| 17:00 | 离会 | |
报名费用:
| 报名费用 | 汇款时间 | RMB |
| 标准会费(6月26日24:00前转账缴费) | 2200元 | |
| 现场会费(6月27日00:00起现场现金缴费) | 2600元 |
报名方式:
1、填写报名回执并发送邮件至meeting@biopharmpt.com
2、添加微信公众号:NJ_Biopharmpt,如您通过微信收到关于本次培训的报名通知,则可通过手机端完成报名
3、QQ咨询:1450592620
4、电话报名:025-86905305
通过QQ或微信报名成功,即可获得100元减免金!
南京高新生物医药公共服务平台
Nanjing Biopharmaceutical Innovation Platform Co. Ltd (BIP)






评论