在设计药物的 DDI 评估策略之前,需要对药物本身的性质特征有所了解。因此,我们首先来回顾一下抗体药物偶联物(Antibody-Drug Conjugates,ADC)的相关特征。ADC 由抗体+linker+毒性小分子组成(图 1)。其中,抗体保证靶向性,小分子发挥药效(如抗肿瘤的细胞毒性),而 linker 保证了ADC 在体循环中的稳定性以及在靶标组织细胞中的可降解性。目前,ADC 药物的给药方式多为注射,适应症多数为抗肿瘤。
根据图 2 所示,ADC 的作用机制可以概述为如下过程:
- 血液循环中的 ADC 与肿瘤细胞表面的靶抗原结合后,通过内吞作用进入细胞;
- 内化的抗原-ADC 复合物进入溶酶体途径;
- 酸性环境和蛋白酶使得 linker 断裂释放毒性小分子;
- 释放的毒性小分子作用于肿瘤细胞中的 DNA 或微管,抑制肿瘤 DNA 复制,诱发细胞凋亡。
如图 3 所示,ADC 的作用机制和抗体+小分子的组成特点也形成了其在体内比较特殊的代谢清除途径,主要包括:
- 靶点介导的清除 TMDD(抗体特征)
- 免疫原性介导的清除(抗体特征)
- 非特异性水解/代谢(抗体特征)
- 毒素小分子特异性脱落(靶细胞内的目标性脱落,抗体特征)
- 游离毒素小分子的代谢清除(CYP 代谢酶和转运体介导)
可以看出,DDI 相关的代谢酶转运体底物研究主要集中在毒性小分子上,而抗体 linker 部分不通过常规的药物代谢酶的转运体代谢消除,无需进行相关底物研究.

图 1. ADC 药物的组成
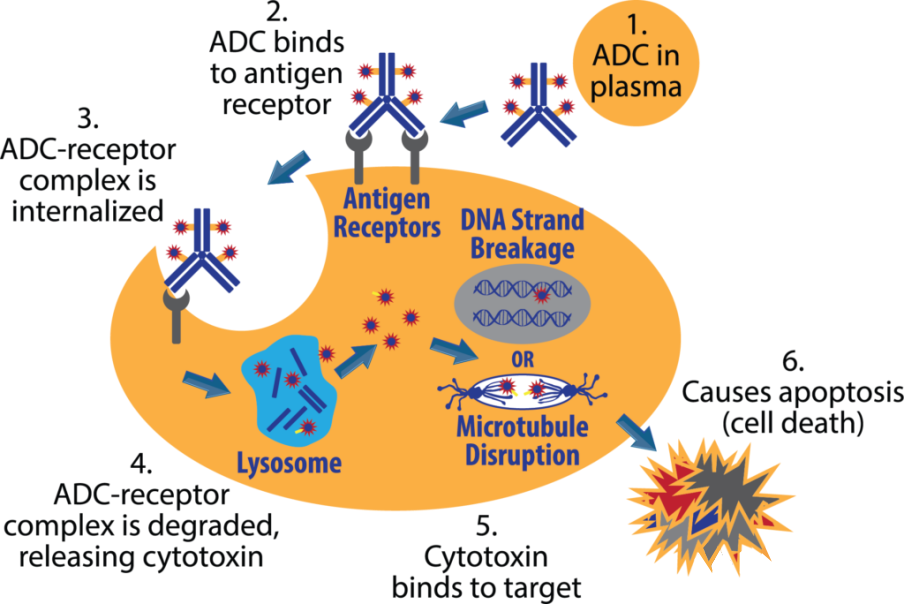
图 2. ADC 药物的作用机制

图 3. ADC 药物在靶细胞内的代谢清除过程
目前,针对 ADC 药物的相关 DDI 评价观点和策略可以参考如下三个指导原则(白皮书):
- FDA《Drug-Drug Interaction Assessment for Therapeutic Proteins Guidance for Industry》
- FDA《Clinical Pharmacology Considerations for Antibody-Drug Conjugates》
- 白皮书(业界共识)《Current Approaches for ADME Characterization of Antibody-Drug Conjugates: An Industry White Paper》
经验总结如下:
1)抗体部分依照大分子 DDI 指导原则进行:
1.1)与调节细胞因子(免疫水平)相关的抗体;
1.2)除此以外,还需要考察如下三种情况的药物联用下的 DDI:
- a)与相同药效学靶点药物联用;
- b)与干扰 ADC Fc 区域与 IgG 与 FcRn 结合的药物联用;
- c)如果 ADC PK 受到免疫原性影响,需要考量免疫抑制剂与 ADC 之间的 DDI。
2)毒素小分子依照基于代谢酶和转运体 DDI 的指导原则进行;
3)发挥药效的主体是毒素小分子,且毒素小分子安全窗口窄,因此重点关注毒性小分子:
3.1)毒素小分子在外周血液循环中的暴露量很低,作为「加害者」(抑制剂诱导剂研究)的风险极小;
3.2)重点关注毒性小分子作为「受害者」(底物研究)的风险:
- a)酶诱导剂对毒素小分子的影响:外周不发挥主要药效作用,则不用考虑临床 DDI;
- b)酶抑制剂对毒素小分子的影响:外周浓度上升会引发安全性问题,需要考虑临床 DDI。
3.3)需要考察毒素小分子活性代谢物的 DDI 风险。
1)体外 DDI 评估时间:
- IND 申报之前(适应症多为抗肿瘤,I 期直接入组肿瘤患者,肿瘤患者存在合并用药,需要为合并用药和风险控制措施提供科学性依据);
- 临床 DDI 可直接合并到其他I期 PK 试验中同时进行(参考后文中的案例)。
2)体外 DDI 评估策略:
- 已上市小分子毒素直接参考申报资料,必要时按照新指导原则要求或新适应症补充;
- 新毒性小分子按照基于代谢酶和转运体的 DDI 指导原则要求完成全套评估(重要性从高到低排序):
- a)酶底物(代谢稳定性、代谢途径鉴定)
- b)转运体底物
- c)酶抑制酶诱导
- d)转运体抑制
- e)CASE BY CASE 原则(例如,靶向肝癌细胞,需要考虑肝脏酶抑制转运体抑制研究)
基于已经公开的申报资料和文献,对 Adcetris(安适利)开发过程中进行的 DDI 研究做了总结,具体如下:
1)药物简介:
- 商品名:Adcetris(安适利)
- 通用名:brentuximab vedotin(注射用本妥昔单抗)
- 靶向 CD30的单克隆抗体+MMAE 组成的 ADC 药物
- 治疗复发或难治性系统性间变性大细胞淋巴瘤(sALCL)或 CD30 阳性霍奇金淋巴瘤(HL)成人患者
2)体外 DDI 研究内容和结果:
2.1)MMAE 是 P-gp 底物,但是对 P-gp 无强抑制作用;
- 在 1、10 和 100uM下 的 B→A 的透过率远高于 A→B 的透过率。P-gp 抑制剂存在下的外排比率显著下降;
- 对 P-gp 对转运 Digoxin 的活性有轻微抑制作用,IC50 大于 50uM。
2.2)MMAE 不是 BCRP、MRP2、OATP1B1、OATP1B3、OCT2、OAT1 和 OAT3 的底物;
2.3)MMAE 是 CYP3A4 的底物;
2.4)MMAE 在人肝细胞中的代谢物在大鼠和猴肝细胞中均有检测到。
2.5)C4、C7、C8 为 MMAE 的主要代谢物:
- 代谢物体外活性评价显示,C4、C7 和 C8 对 CD30 阳性肿瘤细胞的细胞毒性,IC50 分别为 0.9nM、31nM和0.01nM(=MMAE);
- 代谢物生成途径鉴定发现,C4 和 C8 通过 CYP3A4 生成,C7 通过 CYP3A4 和 CYP2D6 生成。
2.6)MMAE 对 CYP1A2、2B6、2C8、2C9、2C19 和 3A 无诱导作用;
2.7)MMAE 对 CYP1A3、2B6、2C8、2C9、2C19、2D6 和 CYP3A 代谢睾酮无可逆抑制作用,但是对 CYP3A 代谢米达唑仑的活性有抑制作用,IC50=10uM;
2.8)MMAE 对 CYP3A 存在时间依赖性作用,作用来源于中间产物 C10,kinact 和 KI 分别为 0.10min-1 和 1.12uM
3)临床 DDI 研究内容
3.1)试验标题:Adcetris 与 CYP3A4 底物药物、抑制剂和诱导剂之间的 DDI 评估及其排泄途径的评价
3.2)试验主要目的:
- a)药物相互作用:
- b)确定 MMAE 的主要排泄途径
Adcetris 的安全性和耐受性评估
免疫原性的评估
MMAE 代谢物鉴定
4)临床 DDI 研究设计
4.1)分组:三个给药组、开放标签、I期试验、间隔21天的2次给药(2 个给药周期);
- a)米达唑仑合并给药组:Adcetris 分别在给药周期1和2的第一天 IV 给药 1.8mg/kg,米达唑仑分别在给药周期1的前三天和后三天给药 1mg,分别在给药周期 1 的前三天和后三天采血至 24 小时;
- b)利福平合并给药组:Adcetris 分别在给药周期 1 和 2 的第一天 IV 给药 1.8mg/kg,从给药周期 1 的第 14 天开始到给药周期 2 的第 21 天为止每天经口给药利福平 600mg,分别在各给药周期的第一天采血数次,在第 2-5 天每天采血一次,3 周后每 2 周采血一次;
- c)酮康唑合并用药组:Adcetris 分别在给药周期 1 和 2 的第一天 IV 给药 1.2mg/kg,从给药周期 1 的第 19 天开始到给药周期 2 的第 21 天为止每天经口给药酮康唑 400mg,分别在各给药周期的第一天采血数次,在第 2-5 天每天采血一次,3 周后每 2 周采血一次;
- d)利福平合并给药组用于评估 MMAE 的排泄途径:从给药 Adcetris 开始到给药利福平之前的时间段内,收集一周的粪便和尿液;
4.2)例数:每组 12 例,一共 36 例患者;
4.3)评价参数:
药代参数:Adcetris、CYP3A4 药物的血药浓度、游离型 MMAE 和总抗体浓度
安全性
4.4)数据分析:Cmax、Tmax、AUC、Vss、CL、消除半衰期...
5)临床 DDI 研究结果
Adcetris 对米达唑仑的PK无影响;
利福平对 ADC 本身暴露量无影响,但是使得 MMAE 暴露量下降了 46%;
酮康唑对 ADC 本身暴露量无影响,但是使得 MMAE 的暴露量提高了 34%。
6)说明书内容中对于 DDI 部分的表述
6.1)在与 CYP3A4 强抑制剂联用时需要密集检测不良反应;
6.2)体外研究显示 MMAE 是 CYP3A 的底物和抑制剂;
6.3)已上市药物对 Adcetris 的影响:
MMAE 主要通过 CYP3A 代谢,与 CYP3A4 强抑制剂酮康唑联用时,MMAE 的暴露量会提高 34%,因此患者同时服用 CYP3A4 抑制剂时需要密集检测不良反应;CYP3A4 强诱导剂利福平会使得 MMAE 的暴露量下降 46%。
6.4)Adcetris 对已上市药物的影响:
Adcetris 不影响 CYP3A4 底物药物米达唑仑的暴露量。MMAE 在临床血药浓度下对其他 CYP 酶也无抑制作用。因此认为 Adcetris 对 CYP3A4 底物药物的暴露量无影响。
1)抗体部分依照大分子 DDI 指导原则,依据抗体本身作用机理进行设计;
2)毒素小分子依照基于代谢酶和转运体 DDI 的指导原则进行:
已上市的小分子可直接参考申报资料;
全新小分子理论上做全套体外 DDI 试验,重点关注代谢酶转运体底物研究;
需要考察毒素小分子活性代谢物的 DDI 风险;
如果是底物,需要考虑进行临床 DDI 研究,可以与其他临床药理试验合并进行。
参考资料
1.FDA.Drug-Drug Interaction Assessment for Therapeutic Proteins Guidance for Industry.
2.FDA.Clinical Pharmacology Considerations for Antibody-Drug Conjugates.
3.Kraynov E et al. Current Approaches for ADME Characterization of Antibody-Drug Conjugates: An Industry White Paper. Drug Metabolism and Disposition. 2015, 15.
4.Mahmood I. Effect of Intrinsic and Extrinsic Factors on the Pharmacokinetics of Antibody-Drug Conjugates (ADCs). Antibodies. 2021, 10 (40).
5.Lievano FA et al. Risk Minimization of Antibody-Drug Conjugates in Oncology: A Review. Drug Safety. 2021.
6.ADCETRISTM (brentuximab vedotin) for Injection For intravenous infusion.FDA Label.
7.ADCETRISTM (brentuximab vedotin)非临床和临床申报资料.PMDA.
上海瑞德是 2002 年在上海张江成立的生物医药外包服务企业,基于体外生物技术的项目服务和产品服务,填补了新药评价服务链的空白,为行业的领军企业之一。
瑞德的体外服务支持从发现到非临床和临床的新药创制,包括筛选和 IND/NDA 申报。申报项目的科学性、真实性、溯源性均通过了相应药监部门的考核,成功地支持了在中国和美国上市。
瑞德的体外产品,如人和实验动物的原代细胞和细胞株、亚细胞组分、生物试剂、培养基等,都根据具体体外服务,事先验证了功能和质量(Tested / Qualified Product, TQP),有力的支持了新药创制和生物医学研发的多快好省。
瑞德具有国际水平的研发团队、企划团队、客服团队和产学研基地。
关于 ADMET 产品:
电话:021-50805153 / 021-50800743;
QQ: 3356196890 / 1924493250;
电话:021-50805153*208
邮箱:services@rild-biotech.com
地址:上海市张江高科牛顿路 200 号 5 号楼
关注微信公众号:瑞德肝脏RILDbiotech,了解更多资讯!





评论