在日常生活中,人们常常 「谈癌色变」,对于科研工作者来说,也是深感无力,因为肿瘤细胞几乎不可控。
随着对细胞死亡研究的不断深入,科学家们发现了一种新的细胞死亡方式 -- 铁死亡。由于铁死亡的激活可导致肿瘤细胞的死亡,因此这种受调控的细胞死亡方式使得治疗癌症成为可能。
还记得吗?半年前小编曾以两篇高分文章为例,带着大家领略了一下铁死亡的研究思路:第一篇是关于 p53 能够通过 SLC7A11 调节胱氨酸代谢,调控 ROS 应答并通过铁死亡抑制肿瘤生长;第二篇则是关于能量胁迫可以激活 AMPK 激活,从而抑制 ACC 并降低花生四烯酸的合成,最终抑制铁死亡。
鉴于铁死亡热度如同这火热夏季一般持续不减,小优也是在持续关注,在查阅文献中发现一篇 53 分的高分文章,忍不住要拿出来与大家分享一番。内容较多,干货满满,必要时请收藏保存。

文如其名,属实可以让我们 「大开眼界」!文章主要介绍了铁死亡的关键分子机制,描述了铁死亡与肿瘤相关信号通路之间的串扰,并讨论了铁死亡在全身治疗、放射治疗和免疫治疗中的潜在应用。
那么为了方便大家快速阅读文章,小编也整理出了文章的核心观点:
1. 铁死亡是一种调控细胞死亡的形式,主要依赖于铁介导的氧化损伤和随后的细胞膜损伤。
2. 铁死亡可通过两种主要途径引起:外源性 / 转运体依赖途径,以及内源性 / 酶调节途径。
3. 铁积累的增加,自由基的生产,脂肪酸供应和脂质过氧化的专用酶是诱导铁死亡的关键。
4. 多个氧化和抗氧化系统,与自噬和膜修复机制共同作用,形成了铁死亡中脂质过氧化的过程。
5. 在形成肿瘤的过程中中,铁死亡在肿瘤促进和抑制中具有双重作用,这取决于损伤相关分子模式的释放和肿瘤微环境中铁死亡损伤引发的免疫反应的激活。
6. 铁死亡影响化疗、放疗和免疫治疗的疗效,因此联合靶向铁死亡信号的药物可以改善铁死亡这些治疗的结果。
好嘞,相信大家浏览完上述内容,已经对文章大意有所了解,接下来让我们细细研磨这篇文章的精华,感受高分文章的魅力所在吧!
首先,什么是铁死亡?
铁死亡是铁依赖性的、非细胞凋亡性的细胞死亡形式。它主要是细胞内脂质活性氧(ROS)生成与降解的平衡失调所致,当细胞抗氧化能力降低,脂质活性氧堆积,就能引起细胞氧化性死亡,即铁死亡。
铁死亡可以通过外部或内在的途径被引发。外部途径是通过抑制细胞膜转运体如胱氨酸 / 谷氨酸转运体 (也称为 XC-系统) 或通过激活血清转铁蛋白和乳转铁蛋白来启动的。内部途径通过细胞内抗氧化酶 (如谷胱甘肽过氧化物酶 GPX4) 的阻断而被激活。

图 1 铁死亡的分子机制
以抑制铁死亡通路为例。胱氨酸(Cys2)经 XC - 系统进入细胞,然后被氧化成半胱氨酸(Cys),Cys 用于谷氨酸 - 半胱氨酸连接酶 (GCL) 和谷胱甘肽合成酶 (GSS) 催化合成谷胱甘肽 (GSH) 的反应。GPX4 利用 GSH 作为还原辅助因子,能够将脂氢过氧化物还原为脂醇。GSH-GPX4 抗氧化系统在保护细胞免于铁死亡中起着重要作用。AIFM2-CoQ10、ESCRT-III 膜修复和 GCH1-BH4 体系也能抑制铁死亡。
一、铁死亡的氧化损伤
铁积累和脂质过氧化是在铁死亡过程中引发膜氧化损伤的两个关键信号。铁死亡的核心分子机制涉及调节氧化损伤和抗氧化防御之间的平衡。
在动物模型中,由于多个水平的干预 (如增加铁吸收、减少铁储存和限制铁外流) 导致铁增加,通过完整信号通路促进了铁死亡。
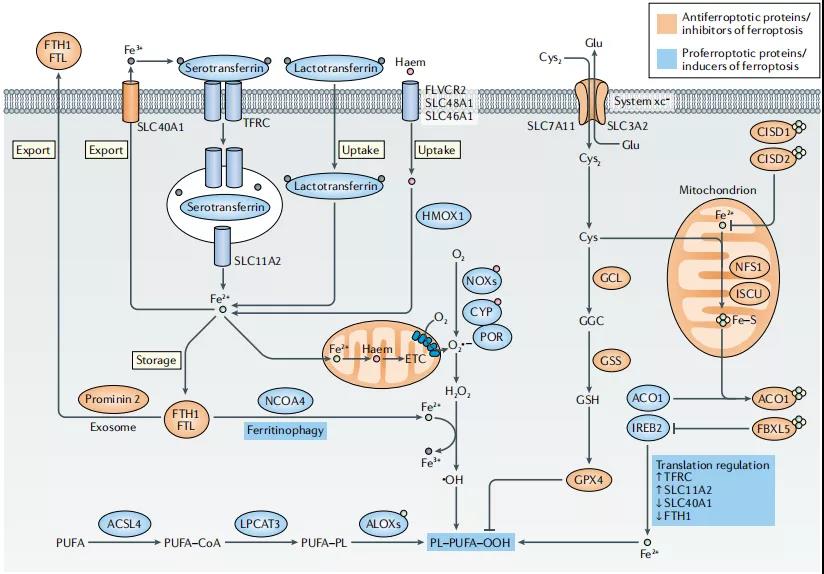
图 2:铁死亡中的铁代谢
载铁的血清转铁蛋白 - 转铁蛋白受体 (TFRC) 复合物通过核内体内化,通过自然抗性相关巨噬细胞蛋白 (SLC11A2) 释放铁 (Fe2+) 到细胞质中。乳转铁蛋白和血红素通过细胞膜中不同的摄取途径提供额外的铁来源。Fe2+ 主要通过细胞膜上的溶质载体家族 (SLC40A1) 输出,但也可以通过外泌体作为铁蛋白输出。铁死亡在翻译水平上受铁调节蛋白 (IRPs) ACO1 和 IREB2 的调控。
在铁死亡中,多不饱和脂肪酸 (PUFAs),特别是花生四烯酸和肾上腺酸,最容易发生过氧化反应,从而导致脂质双分子层的破坏,影响膜功能。细胞膜中 PUFAs 的生物合成和重构需要 ACSL4 和 LPCAT3 酶。ACSL3 将单不饱和脂肪酸 (MUFAs) 转化为酰基辅酶 A 酯,并与膜磷脂结合,从而保护癌细胞免受铁死亡。AMPK 介导的 beclin 1 磷酸化通过抑制还原谷胱甘肽 (GSH) 的产生来促进铁死亡,而 AMPK 介导的 ACAC 磷酸化被认为通过限制 PUFA 的产生来抑制铁死亡。
了解了一些促进和抑制铁死亡的的分子机制,相信大家已经有所收获了,接来下作者就铁死亡在癌症中的相关通路做了详细总结。
二、铁死亡中癌症相关通路
RAS
RAS 家族的致癌基因 (HRAS、NRAS 和 KRAS) 是所有人类癌症中最常见的突变基因。Sotorasib 是一种 KRAS-G12C 突变蛋白的直接抑制剂,在 NSCLC73 患者中具有很好的活性,另一种选择性抑制剂 Adagrasib 也显示出较好的临床活性。RAS 或其下游信号分子 (BRAF、MEK 和 ERK) 的基因或药理性的抑制作用逆转 Erastin 和 RSL3 的抗癌活性,可能是因为 RAS 基因突变信号通过调节铁代谢相关基因的表达,如 TFRC、FTH1、FTL 丰富了细胞的铁水平。这些临床前研究结果支持了我们的观点,即诱导铁死亡可能构成一种适合的策略来对抗致癌的载 RAS 肿瘤。
TP53
一些代谢相关基因,如 SAT1、FDXR88 和 GLS2 在各种条件下都被报道为 p53 介导的铁死亡的直接靶点。p53 可以通过直接结合二肽基肽酶 DPP4 来抑制人结直肠癌 (CRC) 细胞中 NOX 介导的脂质过氧化或通过诱导纤维肉瘤细胞中 CDKN1A 的表达来限制铁死亡。
p53 的表达增加了 erastin 诱导的 ROS 生成,部分依赖于 SCL7A11 表达降低:

(图 3 与图 4 皆引自 Upregulation and activation of p53 by erastininduced reactive oxygen species contribute tocytotoxic and cytostatic effects in A549 lung cancer cells)
以在 A549 细胞中的实验为例,结果表明:
3A:A549-p53si 细胞中的 ROS 水平低于 A549-CTLsi 细胞中的 ROS 水平
3B:SCL7A11si 有效敲低 SCL7A11 的表达,而又不干扰 p53 的表达
3C:单敲低和共敲低均能抑制 ROS,p53 可能通过抑制 SCL7A11 而部分诱导了 ROS 的产生
Erastin 诱导 p53 表达对 A549 细胞产生细胞毒作用,导致铁死亡和凋亡:

图 4
结果表明:
图 4 A.B:erastin 可以有效抑制 A549 细胞的存活。Si-p53 减弱了 erastin 的细胞毒性。
通过检测 caspase-3 活性而确认的凋亡(图 4 C),p53 的敲低抑制了 erastin 诱导的细胞死亡,如 CFSE / PI 双重染色(图 4 D)。
通过在不干扰 caspase-3 活性的情况下抑制细胞铁死亡(图 4 E),p53 敲低也抑制 erastin 诱导的凋亡作用(图 4 F.G)
迄今发表的数据不仅表明脂质过氧化是铁死亡的一个关键因素,而且还表明铁死亡的单个 p53 靶基因或结合蛋白在整体中的重要性可能是细胞类型特异性的。
NFE2L2
临床前研究表明,NFE2L2 信号转导是抗铁死亡的重要防御机制,并参与了 Sorafenib 在 HCC 细胞中的导入。NFE2L2 通过反式激活几个与铁代谢、GSH 代谢和 ROS 解毒酶有关的细胞保护基因来限制铁死亡中的氧化损伤。NFE2L2 的功能增益突变或 KEAP1 的功能缺失突变进一步增加了氧化应激反应的复杂性,这反过来可能影响对铁死亡的抗性。

(图 5:KEAP1 的蛋白质结构域与图 6 皆引自 NRF2 and the Hallmarks of Cancer)
KEAP1 由一个 N 端结构域 (NTR)、一个 Broad-Complex、轨道、bric-à-brac (BTB) 结构域、一个干预区 (IVR) 和六个与 C 端结构域 (CTR) 结合的 Kelch 结构域组成,这些结构域与 NRF2、p62 和其他 E/ STGE 蛋白相互作用。BTB 结构域对于 KEAP1 二聚和与 CUL3 的相互作用非常重要,它包含一个半胱氨酸残基 (C151),可以感知活性氧 (ROS) 和亲电试剂。位于其他 KEAP1 结构域的其他半胱氨酸残基对其他刺激有响应 (未显示)。

图 6:NRF2 的信号通路
NRF2 受 E3 泛素连接酶复合物的负调控:KEAP1-CUL3-RBX1 复合物、β-TrCP-SKP1-CUL1-RBX1 复合物和 HRD1。当 NRF2 蛋白在暴露于活性氧 (ROS)、亲电试剂或自噬异常调节后而升高时,NRF2 会转位到细胞核,与 sMAF 蛋白二聚,并与抗氧化反应元件 (ARE) 结合,激活其靶基因的转录。图 6 指出了 NRF2 靶基因调控的一般过程的例子。
HIF
在 HT-1080 纤维肉瘤细胞中,缺氧诱导表达的 HIF1α 通过增加脂肪酸结合蛋白 3 和 7 的表达来抑制铁死亡,从而促进摄取脂肪酸和增加储存脂质的能力,避免随后的脂质过氧化。相反,在 RCC 来源的细胞中,EPAS1 的激活通过上调 HILPDA 的表达来促进铁死亡,从而增加 PUFA 的产生和随后的脂质过氧化。因此,有效控制 HIF 介导的信号对维持脂质稳态以形成铁死亡性反应是必要的。

图 7:EGLN2 介导的 HIF1A 下调促进了铁死亡(引自 Clockophagy is a novel selective autophagy process favoring ferroptosis)
7A:用 RSL3 (0.5 μM) 处理 HT1080 和 Calu-1 细胞 12 小时后,对内参和 EGLN2 敲除 (EGLN2KD) HT1080 和 Calu-1 细胞中的指示蛋白进行 Western blot 分析。
7B :Western blot 检测 HT1080 和 Calu-1 细胞中 RSL3 (0.5 μM) 在无 adaptaquin (4 μM) 作用 12 小时后的表达情况。
7C.D :RSL3 (0.5 μM) 在没有或有 chetomin (0.25 μM) 和 KC7F2 (25 μM) 作用 12 小时后的 MDA 水平 (C) 和细胞死亡 (D) 分析 (n = 3,*P < 0.05)。
7E:在缺氧 (1% O2) 处理 24 小时后,对 HIF1A 敲低 (HIF1AKD) HT1080 和 Calu-1 细胞中指示蛋白做 Western blot 分析对照。
7F~I:分析 MDA 水平 (F), 细胞死亡 (G), 脂滴 (H) 和基因 mRNA (I) 表示的在缺氧 (1% O2, 24 小时) 预处理后进行在 RSL3 (0.5μM), FIN56 (5μM) 12 小时 (n = 3 * P < 0.05) 条件下 HT1080 和 Calu-1 细胞培养。
结果表明:
1.在 EGLN2 下调或过表达 artnl 的 HT1080 细胞中,使用 HIF1A 抑制剂 (例如,chetomin 和 KC7F2) 或敲除 HIF1A 可恢复 RSL3 诱导的 MDA 生成 (图 7 C) 和细胞死亡 (图 7 D)。
2.缺氧预处理诱导了 hif1a 的表达 (图 7 E)。
3.脂滴的形成,在 RSL3 和 FIN56 的响应下,通过缺氧诱导的 HIF1A 激活得以恢复 (图 7 H)。
综上所述,这些发现证实了 HIF1A 是铁死亡的促存活因子,而 EGLN2 介导的 HIF1A 下调促进了铁死亡。
EMT
LYRIC 蛋白 (又称异粘蛋白) 是 EMT 的正调节器,通过抑制 GPX4 和 SLC3A2 的表达来促进铁死亡。CD44 依赖的铁内吞作用增加促进铁依赖的去甲基化酶的活性,促进与 EMT 信号相关的基因的表达,从而使乳腺癌细胞对铁死亡敏感。这些临床前研究的数据表明,EMT 可能会导致对基于铁死亡的治疗的易感性。

图 8:EMT 在铁死亡中的作用
在上皮细胞中,细胞 - 细胞接触抑制铁死亡,部分是通过钙粘蛋白 1 介导的抑制 YAP1 转录活性。相比之下,间充质状态的细胞由于细胞 - 细胞接触的缺失和参与上皮 - 间充质转化 (EMT) 的因子的激活,如 ZEB1、SNAI1 和 TWIST1,容易发生铁死亡。
那么哪些药物可能是通过铁死亡的途径来治疗肿瘤呢?它的作用机理是什么呢?作者下文也展开了探讨。
三、肿瘤治疗中的铁死亡
系统治疗
传统的细胞毒性和靶向药物通过多种机制发挥作用,其总体目标是通过诱导癌细胞死亡而不影响未转化细胞来减缓或阻止肿瘤生长。越来越多的临床前证据表明,诱导铁死亡可能是一种有用的治疗策略,可预防对多种癌症疗法(如拉帕替尼、厄洛替尼、曲美替尼、达拉非尼和威罗菲尼)的获得性耐药。
免疫疗法
免疫检查点抑制剂(ICIs)主要通过激活有效的细胞毒性 T 细胞驱动的抗肿瘤免疫反应来发挥作用,而细胞毒性 T 细胞驱动的免疫可诱导癌细胞中的铁死亡(图 9)。
1.IFN-γ 诱导死亡的活性 2.TGFβ1 诱导铁死亡的活性 3. 铁死亡的免疫调节作用

图 9:铁死亡在肿瘤免疫中的作用
1.CD8+ T 细胞释放的 IFN-γ 通过激活 JAK1-STAT1 信号通路诱导肿瘤细胞铁死亡,JAK1-STAT1 信号通路转录调控 SLC7A11 和 4F2 细胞表面抗原重链 (SLC3A2) 的表达。
2.许多类型的细胞 (如巨噬细胞) 释放的 TGFβ1 通过 SMAD 蛋白介导的信号激活促进肿瘤细胞铁死亡,从而转录调控靶基因的表达。
3.铁性肿瘤细胞释放损伤相关分子模式 (DAMPs),如高迁移率族蛋白 B1 (HMGB1)、KRAS-G12D 和 8 - 羟基鸟苷 (8-OHG),影响肿瘤微环境中固有免疫细胞 (如巨噬细胞) 的功能。
4.淋巴组织中的肿瘤细胞,如转移性黑色素瘤细胞,脂质过氧化水平较低,因此限制了铁死亡,并比在血液中具有更高的转移潜能。
放疗
放疗主要诱导 DNA 损伤下游细胞的凋亡。ATM 介导的 SLC7A11 下调与放疗诱导的癌细胞中铁死亡有关,而在皮下肿瘤模型中,放疗联合 ICIs 会使这种抗癌作用增强。除了下调 SLC7A11,放疗还上调 ACSL4,从而增加脂质合成和随后的氧化损伤,从而诱导铁死亡。

图 10:铁死亡在放射治疗中的作用
放疗可通过多种机制引起癌细胞的铁死亡。抑制 SLC7A11 激活 ACSL4 的表达,从而促进 PUFAs 插入到膜磷脂中,形成含多不饱和脂肪酸的磷脂 (PUFA-PLs),用于随后的脂氧合酶介导的氧化。受辐射的肿瘤细胞释放的微粒 (RT-MPs) 主要通过铁死亡来产生,这种微粒可诱导旁效应。环状 GMP-AMP 合成酶 (cGAS) 的激活信号诱导自噬依赖的铁死亡。
纳米疗法
使用携带化学物质或生物材料的纳米粒子将为提高现有的铁死亡诱导剂的疗效以及开发治疗癌症的新诱导剂提供可能性。例如,铁死亡诱导剂醉茄素 A 在水中溶解度较差,对小鼠有毒性。如果使用两亲性可降解的 PH 敏感纳米载体给药,可避免这种不利的药物学特征。然而,纳米颗粒对人类健康的长期影响仍需仔细评估。
四、挑战与看法
靶向调控肿瘤细胞中铁死亡的途径是一种新兴的抗癌策略。尽管对铁死亡的研究迅速发展,但在文末作者仍提出了几个有待解决的挑战。
1. 脂质过氧化对于铁死亡至关重要,但细胞毒性是由该反应本身的产物介导的,还是需要脂质过氧化下游的信号分子介导的,仍有待确定。作者认为,可能是与未知蛋白形成的加合物导致细胞膜透孔的形成,介导了脂质过氧化的致死效应。
2. 肿瘤细胞 (包括癌症干细胞) 的代谢重编程是如何与癌细胞特异性的铁死亡性反应相结合的尚不清楚。
3. 铁死亡激活物可引起骨髓损伤。降低促进铁死亡药物的毒性或脱靶效应仍然是一个挑战。
4. 为了最大限度地提高预铁死亡症治疗的疗效,对肿瘤细胞适应和产生耐药性的机制还需更全面的了解。
5. 如何识别对促铁死亡症治疗反应的生物标志物?尽管它们的临床意义尚不清楚,但确定与反应性相关的生物标志物,对制定治疗计划有帮助!
呼,终于快要结束了,小编也累得够呛,不过能够跟大家分享这些前沿的知识,小编也是非常高兴的鸭!
虽然这篇综述结束了,但是相信大家都受益匪浅。身为优宁维小编,也真心地希望我们的解读分享能够帮助到大家,毕竟未来还是需要众位科研工作者同心勠力来创造的,相信我们优宁维能够助力各位乘风破浪,加油!
本文涉及相关产品

好消息
CST 为科研助力,细胞生物学抗体系列促销来袭!
凡是促销活动期间购买细胞生物学相关抗体即可获得环保清新马克杯
小优准备好了,等你来寻!


促销规则
1.促销时间:2021 年 6 月 15 日 - 2021 年 7 月 30 日。
2.促销内容:在促销期间,购买任意一支清单内 S/L 包装抗体,即可获赠马克杯一个。
3.促销编码:CN2021B1GG,请在和优宁维下单时出示。





评论