
关于溶瘤病毒
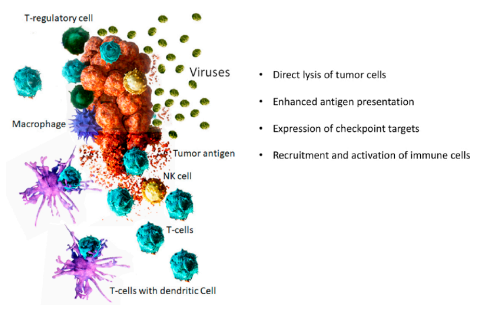 (图为溶瘤病毒抗癌作用机制)
(图为溶瘤病毒抗癌作用机制)
01 疱疹病毒 (HSV)
疱疹病毒 (HSV):包膜双链 DNA 病毒,呈球形,完整病毒由核心、衣壳、被膜(Tegument)及囊膜组成核心含双股 DNA,缠绕成纤丝卷轴。衣壳呈二十面体对称,由162 壳微粒组成,直径 100 nm 。
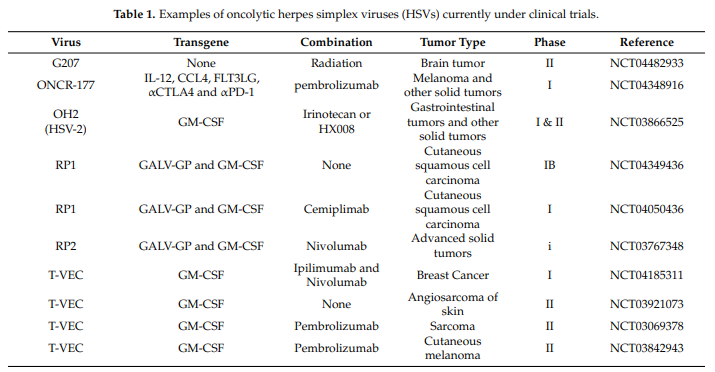
01 T-VEC
02 G 207
03 G 47△
04 ONCR-177
05 RP 1/2
02 牛痘病毒(VV)

01 Pexa-Vec(JX-594)
02 GL-ONC 1(GLV- 1 h 68)
04 vvDD(JX- 929 或 vvDD-CDSR)
03 腺病毒(Adenovirus)
01 H101(Oncorine)
03 Enadenotucirev
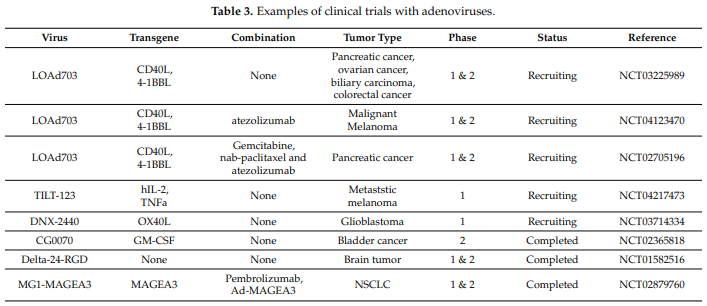
04 LOAd 703
05 ONCOS-102 (CGTG-102
04 呼肠孤病毒 (Reovirus)

05 展望









评论