1. 简介
Western blot 是一种检测样品中目的蛋白是否存在的一种生物技术。首先经过凝胶电泳根据蛋白质分子量大小将蛋白质分离开来,接着将蛋白质转移到硝酸纤维素膜或 PVDF 的膜上,之后对膜上的目的蛋白进行一抗、二抗孵育以及显色处理,进而对目的蛋白进行定性或半定量分析。Western blot 相比于其他的抗体免疫检测方法例如 ELISA,在某些方面更具优势。Western blot 可以根据抗体与非靶蛋白的交叉反应性将靶蛋白检测出来,并同时可测出靶蛋白的分子量。2. 样品准备-蛋白提取
Western blot 第一步是从细胞或组织中提取蛋白质,对可溶性的目的蛋白通过分离凝胶进行迁移。裂解液的选择取决于目的蛋白的含量和亚细胞定位,使用含有十二烷基硫酸钠(SDS)和其他离子型洗涤剂的裂解液获得蛋白产量最高,反过来对样品造成的损害也最大。应该注意的是,裂解液的选择会影响接下来抗体选择。需要考虑选择识别蛋白天然形式还是变性形式的抗体。含有 SDS 的裂解液对蛋白有变性作用,如果使用的抗体只能识别蛋白质的天然形式,那么不能选择含有SDS的裂解液,而应该选择含有温和型非离子型去污剂的裂解液,如 NP-40 和 Triton X-100。一般在厂家提供的说明书上可以找到有关抗体识别蛋白质的哪种形式的相关信息。需要注意的是,当需要研究蛋白质-蛋白质相互作用时,应使用不含离子型去污剂的裂解液,一般用含有非离子型去污剂的裂解液。

表1:蛋白定位和裂解液的选择
2.1 RIPA 缓冲液
RIPA(Radio Immuno Precipitation Assay)缓冲液用于裂解和提取培养的细胞中的蛋白。RIPA 缓冲液是一种理想的细胞裂解液,可用于全细胞和膜结合蛋白的提取。由于 RIPA 缓冲液会干扰蛋白质之间的相互作用,所以不能用于免疫共沉淀的蛋白提取。
2.1.1 RIPA 缓冲液配方
50 mM Tris HCl pH7.4,50 mM NaCl,2 mM EDTA,0.1%SDS。用的时候再加上蛋白酶抑制剂(载脂蛋白 Apoprotein,亮肽素 Leupeptin,DTT 和 PMSF)。2.2 NP-40 缓冲液
NP-40 缓冲液广泛用于提取细胞质蛋白、膜结合蛋白和全细胞蛋白。与 RIPA 缓冲液相比,NP-40 缓冲液被认为是比较温和的裂解液。2.2.1 NP-40 缓冲液配方
150 mM NaCl,1.0%NP-40(Triton X-100 可替代 NP-40),50 mM Tris,pH 8.0。2.3 Tris-HCL 缓冲液
20 mM Tris-HCl,pH 7.5。2.4 TRIS-TRITON 缓冲液
10 mM Tris pH 7.4,100 mM NaCl,1 mM EDTA,1 mM EGTA,1%Triton X-100,10% 甘油,0.1%SDS,0.5% 脱氧胆酸盐。以上试剂可在 4℃ 储存数周,在 -20℃ 储存长达一年2.5 蛋白酶和磷酸酶抑制剂
进行细胞裂解的时候,蛋白也会进行降解。为了防止蛋白水解和脱磷酸化,样品必须一直放在冰上。用之前将蛋白酶抑制剂和磷酸酶抑制剂添加到裂解液中以减缓蛋白水解和脱磷酸化的过程。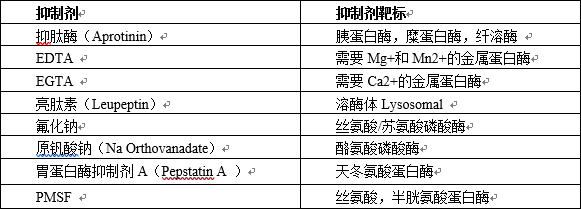
表2:蛋白酶和磷酸酶抑制剂及其靶标
2.6 样品制备-细胞裂解操作流程
1. 用预冷的 PBS 清洗细胞。2. 弃去 PBS。
3. 加入预冷 RIPA 缓冲液(每 10^7 个细胞加入 1ml)。
4. 将贴壁细胞刮下来,收集在 15ml 的离心管中。
5. 将样品进行离心,离心力和离心时间因细胞类型而异。
6. 离心后,将样品从离心机上取出并置于在冰上。
7. 将样品上清取出放入新的离心管中并置于在冰上,丢弃沉淀。
8. 用 Bradford 法、Lowry 法或 BCA 法测定蛋白质浓度,BSA 可作为标准品。
9. 蛋白质浓度测定后,将样品置于 -20℃ 或 -80℃ 保存或立即上样。
2.7 Bradford 法测定蛋白浓度
1. 按照说明书,将每个蛋白样品等量加入 96 孔板中。2. 在每个样品中分别加入等量的 Bradford 试剂,确保没有气泡。
3. 将 96 孔板至于振荡仪上,在室温下温和振动 5 分钟。
4. 读取每个样品的吸光度,根据标准曲线计算出每个样品的蛋白质浓度。标准曲线制备如下:制备 2-15 mg/ml 范围内的 BSA 系列稀释液,取等量的各浓度 BSA 溶液加入 96 孔板中,之后加入等量 Bradford 试剂。
5. 根据说明书,读取 595nm 吸收值。
6. 根据标准曲线计算样品以及各浓度 BSA 溶液的蛋白质浓度。
2.8 样品中加入商业缓冲液
在一些实验中,所使用的抗体只识别蛋白质天然形态,因为抗原表位存在于蛋白折叠结构的表面。在这种情况下,不能对样品进行变性,因此实验过程中不能用含有 SDS 的缓冲液。此外,还原剂例如β-巯基乙醇和二硫苏糖醇(DTT)必须从样品上样缓冲液中除去。 某些抗体只识别变性后的蛋白,热变性会使蛋白的三维展开,抗体结合相应的隐藏在蛋白 3D 构象内的表位。变性的蛋白可以通过使用含有变性剂(如 SDS)的上样缓冲液,在 95-100℃ 加热 5 分钟获得。Western blot 的上样缓冲液是 2x Laemmli 缓冲液。Laemmli 缓冲液含有可以打开蛋白内的二硫键的 β-巯基乙醇和 DTT。Laemmli 缓冲液含有给蛋白提供负电荷的 SDS 成分,以便于蛋白进行凝胶电泳,Laemmli 缓冲液中的甘油成分可以使样本的密度变大。 为了能够使蛋白的迁移可视化,通常在上样缓冲液中加入分子量较小的阴性离子染料(如溴酚蓝)。因为该染料分子量很小,所以它是待分离样品中所有组分中迁移最快的,可以指示蛋白迁移的进度。2.8.1 Laemmli 缓冲液配方
4%SDS,10%β-巯基乙醇,20% 甘油,0.004% 溴酚蓝,0.125 M Tris-HCl, 将 pH 值调至 pH 6.8。3. SDS-PAGE 电泳
样品经过细胞裂解、蛋白浓度测定后,加入上样缓冲液,通过凝胶电泳进行蛋白分离。 用于 Western-blot 的 SDS-PAGE 胶分为两部分,即浓缩胶和分离胶。位于底部的占比例较大的胶是先被灌注的分离胶。分离胶凝固后(一般需要 1 个小时)再倒入浓缩胶。浓缩胶在分离胶的顶部轻轻倒入后,再将梳子插入浓缩胶。分离胶和浓缩胶的基本化学性质是相同的,只是 Acrylamide 浓度和胶的 pH 不同。 浓缩胶孔隙较大,而分离胶的孔隙较小。 凝胶中使用的 Acrylamide 浓度取决于目的蛋白大小和凝胶所需的孔隙大小。 一般来说,对于分子量小的蛋白,应配制含 Acrylamide 浓度较高的凝胶。对于分子量较大的蛋白,应配制含 Acrylamide 浓度较低的凝胶。应该注意的是,Acrylamide 浓度越大,胶的孔隙越小。以下表格整理了不同的蛋白线性分离范围所推荐的胶的 Acrylamide 含量。
表3:Acrylamide 凝胶浓度%和蛋白质线性分离范围
预制胶是可以买到,然而,许多科研人员更倾向亲自配制。以下是 10% 分离胶和浓缩胶的配方。

表4:10% 分离胶配方
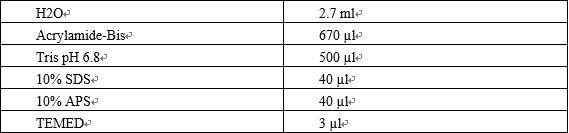
表5:浓缩胶配方
4. 阴性对照、阳性对照以及内参
与所有实验一样,用阴性对照和阳性对照来评估实验的准确性、灵敏性和高效性。内参
使用一定分子量的内参,可以测定出目的蛋白的分子量大小并检测电泳是否正常运行。

表6 内参
5. 制备 SDS-PAGE 胶、跑胶
1. 通过 SDS-PAGE 电泳分离蛋白质。凝胶 Acrylamide 的含量取决于目的蛋白的分子量大小。在以下样品中,用的是含有 10%Acrylamide 的凝胶。2. 将分离胶倒入玻璃板之间。
3. 用 IPA 将分离胶压平。取 300μl 的 IPA 小心地从分离胶的顶部倒入,静置 1 小时。
4. 分离胶凝结后,倒出 IPA,并温和地用水流冲洗干净。
5. 倒入浓缩胶,小心地将梳子放入浓缩胶中,避免气泡。静置 1 小时。
6. 将制备好的凝胶放入电泳仪中,加入 400ml 1x SDS-PAGE 电泳液(15.1g trizma, 94g 甘氨酸, 50ml 10%w/v SDS, ddH2O 至 1L), 用电泳液填充空腔,观察是否有泄漏。
7. 取下梳子,必要时用电泳液冲洗。
8. 在选定的孔位,加入 8μl 未染色的 Marker 和 20μl 的蛋白质样品。
9. 以每块凝胶 25 mA 的电流运行 1 小时 15 分钟。
6. 转膜
电泳结束后,将凝胶上的蛋白质转移到硝酸纤维素膜或 PVDF 膜上。使用最广泛的转膜方法是电泳转移。将含有蛋白质的凝胶放在与转移膜直接接触的位置,两侧分别放上滤纸,淹没在导电溶液中。电场的作用是将凝胶上的蛋白转移并附着在膜上。6.1 样品中加入商业缓冲液
5.8g Trizma 碱,2.9g 甘氨酸,0.37g SDS 粉末,200ml 甲醇,用 ddH20 溶解并定容至 1 L。7. 封闭
蛋白转膜后,加一抗之前,为了避免抗体的非特异性结合,将膜进行封闭是很必要的一个步骤。封闭蛋白膜可以提高实验的灵敏度,降低背景信号。脱脂奶粉和 BSA 是最常用的封闭剂。 封闭剂的选择取决于抗体,因为一些抗体是可以非特异性的与脱脂奶粉结合的。当使用磷酸化蛋白的抗体进行检测时,建议使用 BSA 作为封闭剂。 尤其需要注意的是,如果一抗是针对马,牛,山羊或驴的蛋白,因为潜在的交叉反应以及 IgG 的污染不能用 BSA 或脱脂奶粉进行封闭。7.1 封闭液的配方
1X TBS, 0.1%(v/v)tween-20,5% 脱脂奶粉。8. 洗涤缓冲液
为了去除任何未结合的试剂,并降低背景,洗涤步骤是 Western blot 中很有必要的一个环节。洗涤不充分会导致高背景信号,洗涤次数过多,又会造成蛋白从膜上被洗掉。 洗涤缓冲液中使用的去污剂的量可能会根据实验而有所不同。Tween-20 去污剂的浓度可以从 0.05% 到 0.5% 不等。建议使用新鲜的去污剂,例如 Tween-20 因为微生物的生长会造成较高的背景信号。此外,由于去污剂含有过氧化物污染,所以建议使用高纯度去污剂。8.1 洗涤缓冲液-TBST的配方
20 mM Tris pH 7.5,150 mM NaCl,0.01% TWEEN 20。9. 一抗孵育
为避免一抗的非特异性结合,对蛋白膜进行封闭处理。理想的一抗可以特异性地识别蛋白或者蛋白表位。一抗的选择取决于目的蛋白。选择一抗时,需要考虑很多因素。抗体种属的特异性,由于不同种属蛋白表位可能不同。蛋白的变性和翻译后的修饰可能影响抗体和蛋白之间的相互作用。所以并不是所有的抗体都适用于 Western blot 检测,需要判断。在膜与一抗孵育后,应用洗涤缓冲液洗 5 次,每次 5min。注意:应首先检测信号最弱的,因为实验操作以及抗体洗脱过程可能会使蛋白从膜上解离下来。
10. 二抗孵育
通常一抗是不能被检测的,而标记的二抗可以和一抗相结合,从而可以检测到目标蛋白。二抗的选择取决于一抗所来源的种属以及一抗的标签,如生物素、组氨酸等。例如,如果一抗是未经修饰的兔源单抗,那么二抗必须是除兔种属之外的抗兔二抗。如上所述,二抗可以被不同的小分子标记。对于化学发光检测,一般用 HRP 或 AP 进行标记。对于荧光检测,一般用荧光素进行标记。11. 抗体稀释度
抗体的稀释度通常由厂家推荐。然而,抗体的最佳稀释度可以根据实验的具体情况而变化。蛋白质表达量以及实验的灵敏度越高则需要的抗体越少。使用较少的抗体可以降低背景信号,增加特异性。抗体通常用洗涤缓冲液进行稀释。
12. 显色
二抗上的标签类型决定使用的显色系统。酶标记的抗体,如 HRP 和 AP,用化学发光方法检测。荧光基团标记的抗体,则使用荧光检测设备直接检测。12.1 化学发光
HRP 标记抗体是应用最广泛的抗体。HRP 由于较小的分子量以及抗体的 HRP 标记反应的相容性被认为优于 AP。此外,HRP 底物使用广泛,而且具有较高的活性和稳定性。HRP、AP 的标记物产生的信号是短暂的,只有在酶-底物反应发生时才会持续。优化得比较好的实验,充足的底物产生的化学光可以维持 1 到 24 小时。无论使用 X 光胶片或是数字成像仪都是可以进行成像的。X 光胶片可进行蛋白的半定量分析,而数字成像仪检测的范围较宽可进行蛋白定量分析。Western blot 的化学发光检测通常被认为是半定量分析。12.2 荧光检测
荧光标记抗体因不需使用底物,所以步骤较少,实验步骤更简单一些。然而需要专门的设备、特定的激发光来检测信号。红外、近红外量子点技术的发展提高了用于 Western blot 荧光探针的灵敏度分析。使用荧光检测相对于化学发光检测的优点是能够检测不止一个荧光团。荧光检测可以定量,并且在重复实验中得到的结果一致。荧光检测的劣势是由于自发荧光产生的背景信号,不能检测到表达量较低的蛋白质。12.3 化学发光检测和荧光检测之间的差异比较
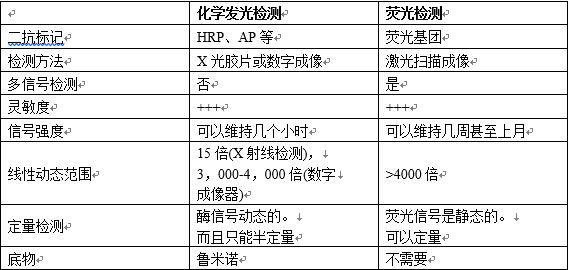
表7 化学发光检测系统与荧光检测系统的比较
13. 抗体洗脱、蛋白膜的再次检测
从 Western blot 膜上去除一次和二次抗体的过程被称为抗体洗脱。抗体洗脱可以实现不止一种蛋白的检测,例如目的蛋白和参照蛋白。由于节省了时间和样品,抗体洗脱在检测多种不同蛋白方面是有优势的。抗体洗脱在 PVDF膜上效果是最好的,因为 PVDF 膜具有更强的吸附蛋白的能力,因而蛋白不易被洗掉。化学发光试剂如 ECL 检测适用于抗体洗脱,因为不会使膜上色,从而不会干扰检测具有相似分子量的目标蛋白的检测。膜再生的次数取决于抗体洗脱方案的优化程度。抗体洗脱后,用洗涤缓冲液彻底清洗膜是很重要的,而且在一抗孵育前需要进行膜的封闭处理。抗体洗脱液分为温和型和强烈性两种不同强度的抗体洗脱液。13.1 温和型抗体洗脱液
温和型的抗体洗脱液通过使用低 pH 的甘氨酸溶液来使结合的抗体解离。低 pH 可以导致抗体结构改变以及活性位点的失活从而去除结合的抗体。13.2 温和型抗体洗脱液的配方
15g 甘氨酸,1g SDS,10ml Tween20,溶于 800ml 蒸馏水,将 pH 调至 2.2,补充蒸馏水使终体积达到 1 L。13.3 强烈型抗体洗脱液
强烈型抗体洗脱液主要用于表达量较高的蛋白的检测。强烈型抗体洗脱液也是通过抗体结构改变以及活性位点的失活的原理来去除结合的抗体。强烈型抗体洗脱液是含有还原剂 β-巯基乙醇和 SDS 的中性 Tris-Cl 溶液。只需将需要再生的蛋白膜置于摇床上 50-80℃ 的此溶液中 45 分钟。应该注意的是,SDS 和 β-巯基乙醇的作用是不可逆的,并且被洗脱下来的抗体也是不可修复的。此外,在使用强烈型的抗体洗脱液后,膜是需要彻底清洗,以防止再次检测的抗体失活。13.4 强烈型抗体洗脱液的配方
62.5 mM Tris-HCL pH 7.8, 100 mM β-巯基乙醇, 2% (w/v) SDS。13.5 强烈型抗体洗脱液操作流程
1. 将 PVDF 膜置于强烈型洗脱液中,在 50℃ 下反应 30 分钟。2. 在摇床上室温下洗膜,依次进行 5 分钟两次,10 分钟一次,5 分钟两次的洗膜操作。
3. 在室温下封闭,将膜放于摇床上,温和地反应 1小 时。
4. 在与一抗、二抗孵育后分别洗膜,洗膜两次,每次 5 分钟。
14. 蛋白胶显色
凝胶电泳分离的蛋白质凝胶可以通过两种方式显色:考马斯亮蓝(Coomassie)染色或铜(copper)染色。染色方式的选择很大程度上取决于蛋白质的下游应用。14.1 考马斯亮蓝染色
考马斯亮蓝染色是用来确定蛋白质是否均匀地迁移。如果目的不是转膜而仅仅是观察 SDS-PAGE 胶上蛋白分离结果,那么就选用考马斯亮蓝染色。因为考马斯亮蓝染色是不可逆的,所以考马斯亮蓝染色只能用于凝胶染色。14.2 考马斯亮蓝染色操作流程
1. 电泳后将凝胶置于含有 40% 的蒸馏水、10% 的醋酸和 50% 的甲醇的溶液中固定。2. 将凝胶放入步骤 1 中相同的溶液成分并添加质量浓度为 0.25% 考马斯蓝的溶液中进行染色。
3. 室温下在摇床上进行染色,染色 4-24 小时。
4. 将凝胶转移到摇床上包含有 67.5% 的蒸馏水,7.5% 的乙酸和 25% 的甲醇的洗涤缓冲液中漂洗。
5. 多余的染料洗掉后,更换新鲜的洗涤缓冲液。
6. 多余染料不会与 Acrylamide 结合,最终会被洗掉洗涤缓冲液,留下清晰的凝胶。
7. 染料与凝胶中的蛋白质紧密结合,显示蓝色。
14.3 铜染
如果蛋白胶显色后,仍旧进行转膜,则应使用铜染色法。铜染色比考马斯亮蓝染色更快更灵敏。14.4 铜染操作步骤
1. 凝胶电泳后,取出 SDS-PAGE 胶后,将 SDS-PAGE 胶在双蒸水中冲洗凝胶。2. 将 SDS-PAGE 胶转移到 0.3M CuCl2 溶液中,染色 5-15 分钟。
3. 在双蒸水中清洗凝胶。
4. 在黑色的背景下观察。
5. 蛋白质为半透明条带,胶的本底色为浅蓝色。
6. 在 0.1-0.25 M Tris/0.25 M EDTA pH 8.0 溶液中脱色。
7. 将凝胶放入转膜缓冲液中,准备进行下一步的转膜操作。
15. 蛋白胶显色
蛋白转膜的效率和成功与否可以通过以下方式进行评估。将 PVDF 或硝酸纤维膜(NC 膜)用丽春红(Ponceau Red)染色。丽春红染色是可逆的,可用洗涤缓冲液洗去,因此能够进行随后的抗体检测。15.1 丽春红染色操作流程
1. 将丽春红原液稀释 100 倍,配成工作液。2. 将 PVDF 膜、硝酸纤维素膜或醋酸纤维素膜浸没在放在摇床上的丽春红染色液中,染色 5 分钟。
3. 用蒸馏水漂洗,直至出现清晰条带。
4. 用 TBST 缓冲液漂洗,去除丽春红(Ponceau Red),进行后续的 WB 检测。
5. 如果使用的是 PVDF 膜,先用甲醇重新激活膜,然后 TBST 清洗。
相关产品
更多产品讯息,请联系四正柏生物。


评论