
对于科研工作者来说,由于动物实验更能模拟人类的生理和病理条件,所以比体外实验更有说服力。
在某个通路或某种疾病的研究中,通常会人为地将外源基因用病毒载体注入动物组织,检测其对其他基因和通路、组织器官、动物行为等的影响。但这类动物实验条件的摸索和优化,是一个难点。
选择何种病毒、如何选择注射的部位、注射多少体积、以及注射后的检测时间等实验条件都需要摸索。
病毒产品该如何选择?
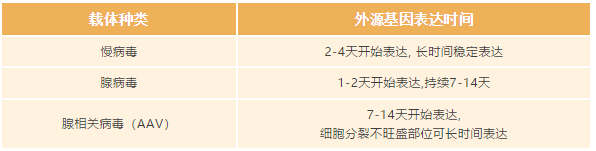
此时您可以根据研究目的,选择适合的产品。
一般需要进行体内动物实验的推荐使用慢病毒和腺相关病毒 AAV,送上福利:点击免费申请试用
慢病毒因其转染效率高、感染谱广、适合体内体外实验等突出优势,广泛应用于基因功能研究,尤其是在肿瘤研究领域。
腺相关病毒(AAV)体积最小,因此载体的容量最小,具有无致病性,扩散效果好,病毒滴度高,且能在转染的宿主细胞中长期表达等优势。AAV 注射动物后,一般会在 1-2 周左右开始表达,体内实验一般建议感染后 3-4 周看第一批结果。在 AAV 中有一类组织特异性 AAV 载体由于其「高效感染 靶向调控」实现在不同组织中特异性的高效表达受到了诸多科研工作者的青睐,点「这里」可以查看科研大咖的亲测分享~~
如何提高病毒的在体实验感染效率?
查询相关的文献,参考文献中病毒用量、注射方法、注射位点等详细信息,再摸索一下实验条件,改变一下病毒的注射方法和用量等。很多情况下,感染效率不好并不是病毒本身的原因,而是由于实验操作步骤、注射位点、或者注射方法的问题导致的。经过一段时间的实验条件摸索,可以得到相对更好的结果。
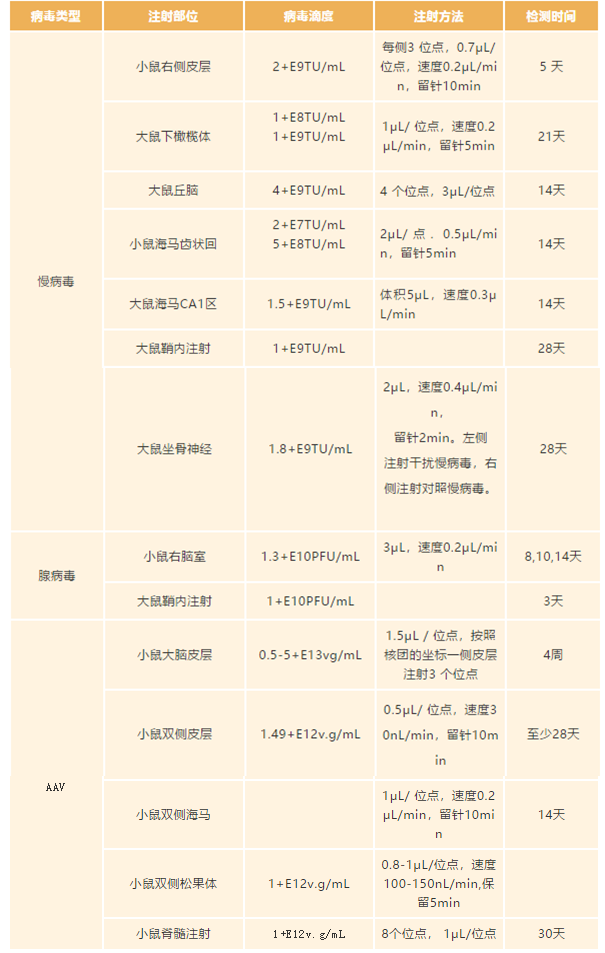
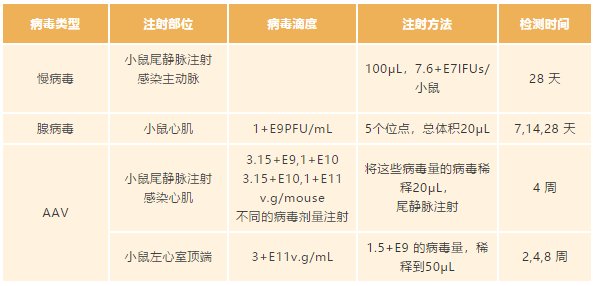
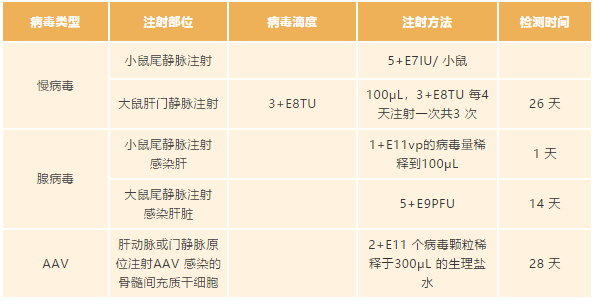
在此给大家分享一些工具病毒在不同系统中的注射剂量参考,相关参数来源于已发表的文章,在体实验应用较多的是慢病毒和腺相关病毒 AAV,并且最广泛的应用于神经系统、心血管系统和肝脏等研究领域。
神经系统
心血管系统
肝脏
肺
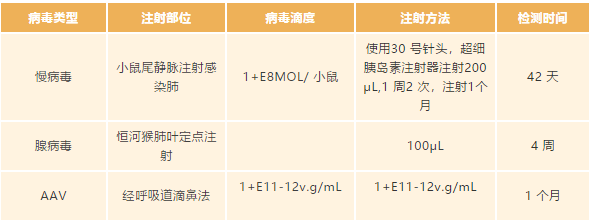
以上给大家介绍了在体实验中病毒该如何选择以及其特点和在不同系统中的注射剂量推荐,接下来给大家解惑一下病毒注射中常遇到的表达效果不好和荧光问题。
病毒注射动物的时候表达不好或非常弱怎么办?
首先需要排除病毒注射手法、实验剂量、取材时间、组织处理、切片上的问题,如果不知道该如何改进实验流程,获取产品技术手册。
大部分情况,往往是实验的手法并不熟练,或者可能没有打准位置,特别是一些带特异启动子的 AAV,观察的时间点太早,导致目的基因还没有表达完全。建议重新摸索实验条件。
不注射病毒的对照也有荧光亮?
常见于组织处理有问题,例如多聚 jiaquan 浸泡时间过久、组织切片染色的时候太干燥,导致非特异性背景过高,在此建议重新改善组织处理的流程。
想了解更多相关资料,扫描二维码来咨询哦












评论