为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医疗器械产品注册工作的管理,进一步提高注册审查质量,鼓励医疗器械研发创新,国家食品药品监督管理总局组织制定了医疗器械临床试验设计指导原则(见附件),现予发布。
特此通告。
附件:医疗器械临床试验设计指导原则
食品药品监管总局
2018年1月4日
2018-01-09 10:47
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医疗器械产品注册工作的管理,进一步提高注册审查质量,鼓励医疗器械研发创新,国家食品药品监督管理总局组织制定了医疗器械临床试验设计指导原则(见附件),现予发布。
特此通告。
附件:医疗器械临床试验设计指导原则
食品药品监管总局
2018年1月4日

药品Ⅰ~Ⅳ期临床试验,医疗器械临床试验
¥200000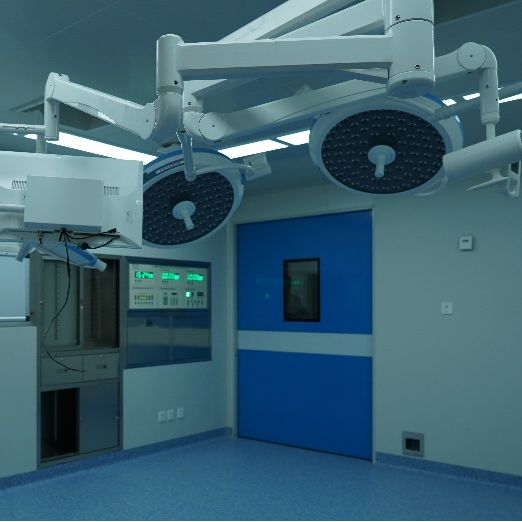
医疗器械临床前安全性评价
询价
药物临床前动物实验 临床前动物实验 专注医疗器械临床前动物实验平台
¥1
专业的医疗器械临床研究公司 承接医疗器械临床试验研究服务
询价
新药、医疗器械临床研究、注册,药理机构认证
¥0
DOTA-tris(tert-butyl ester)
¥5131.88
DOTA-tris(tert-butyl ester)
¥24662.75
Fmoc-Thr(β-D-GlcNAc(Ac)3)-OH
¥9898
Fmoc-Ser(β-D-GlcNAc(Ac)3)-OH
¥9898
(S)-N-Fmoc-2-(4'-pentenyl)glycine
¥2198
评论