产品详情
文献和实验
相关推荐
库存 :大量
保质期 :1年
供应商 :上海泽叶生物科技有限公司
保存条件 :-20
规格 :支
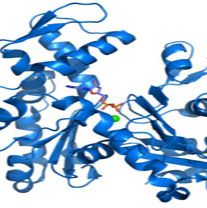
低内毒素水平, 具有卓越的批间稳定性, 25,000+ 特异性抑制剂 & 激动剂, 50+ 化合物筛选库, 标准化质控体系, 质量保障承诺。来源:原核表达
宿主:E.coli
规格:10µg 50µg 200µg 1mg 5mg
内毒素水平:<1.0EU/µg(LAL法测定)具体详见说明书
片段与标签:Asp1208~Val1453 with N-terminal His Tag
物种来源(人、小鼠、大鼠、豚鼠、兔、猕猴、山羊、绵羊、马、牛、猪、鸡、狗等其他物种多物种)相同的名称,不同的物种。
性状:冻干粉
表达系统: 大肠杆菌
产品纯度:>95%-98%(SDS-PAGE & RP-HPLC)
保存条件:如果样品在2-4周内使用,可以在4°C低温储存。
重组蛋白有几个疑点:
1、表达量如何?
2、超声过程中注意冰水浴了吗?
3、“蛋白条带由1条变成3条”是不是说表达后的全菌电泳目标蛋白是一条带,而在超声或溶菌酶处理后这1条带降解成了3条?
4、降解成的3条带中还有原来的融合蛋白条带吗,量如何?
5、变性纯化后的纯度如何?
6、能否把相关电泳图发上来看看?
答:蛋白表达量不高,但也不低;
超声过程一直是在冰上进行的;
全菌电泳目的蛋白是一条带;
降解成3条带后,大部分情况下是有目的融合蛋白的,量比较少;
变性纯化后纯度还是挺不错的。
重组蛋白两个建议:
1、用非变性纯化样品去做EK酶切、纯化。
如果融合蛋白的降解是从N端开始的,而C端没有降解,那么应该能够拿到38肽。
我曾经有个这么个类似情况,酶切后证实是N端降解,C端的目的蛋白好好的,大小都对。
做EK酶切多了,往往会发现,PET32a的融合段硫氧还蛋白加histag部分确实易被进一步酶切水解。但Ni柱的结合特性不变,说明水解是从N端开始的。
先做酶切梯度,电泳确定酶量标准。不要用酶说明书的量,有时候差距非常大。和蛋白种类相关。
酶切后的纯化方法首Ni柱穿透纯化,可能要加少许咪唑及盐,以利用酶切后的目标蛋白不吸附Ni柱。
2、用变性纯化的样品做复性处理
重组蛋白变性纯化的样品纯度不错,查阅一下有关的复性方法资料,设计一个方案。
你用超滤和透析的方法都失败了,可以考虑用稀释的方法,控制终蛋白浓度小于0.1mg/ml,蠕动泵滴入搅拌的稀释液中,pH控制高的,如pH9-10,适当加一些甘油和EDTA,DTT。
影响蛋白原核表达的因素很多,如蛋白的亲水性、密码子的稀有性、蛋白毒性等。如疏水性过强,就难以表达;稀有密码子过多或多个稀有密码子连在一起也难以表达。我以前也遇到过这种情况,首先要分析你的蛋白序列和二级结构,看看是否存在这些影响因素。如果必须要表达全长蛋白,像你这种情况难度就比较大,可以进行密码子的改造,或者更换载体,或者更换宿主菌。看你试验的目的,如果不需要表达全长蛋白,如表达部分抗原性强的片段,可以简单一点,表达部分片段即可。
重组蛋白表达出来的蛋白比实际大小要小,这是为什么?
主要原因有如下几个方面
1. 蛋白本身被降解了,可以存在一些不利于该蛋白稳定的蛋白酶
2. 翻译起始位点的问题:如果一个类似于核糖体结合位点(AAGGAGG)的序列加上适当的间隔序列出现在了ATG密码子上游,降解就会有可能出现。解决的方法可以采用两端都带有融合标签的载体,例如pET系列部分载体在N-端和C-端都有His-Tag融合标签。这样,全长蛋白就可以通过提高咪唑浓度,在洗脱时将截短蛋白与全长蛋白区分开。或者在蛋白两端采用不同标签,进而通过亲和纯化的方式得到全长蛋白。
3. 影响蛋白稳定性的另外一个因素是与N端Met相邻的氨基酸,即N端原则,当下列氨基酸出现在N端时: Arg、 Lys、Phe、Leu、Trp和Tyr 蛋白的半衰期较短,蛋白会存在不稳定降解的问题,特别是Leu,当它出现在第二个位置上时,蛋白极度不稳定。在选择克隆位点时, Nco I 和Nde I都是 是一个比较好的N端的克隆位点选择,而使用NdeI的时候就要特别留意Leu的出现。
重组蛋白如何提高蛋白的可溶性表达比例及表达量?
有些蛋白质表达水平低,或者表达的大多是包涵体,通常情况下通过基因优化,载体及菌株的筛选,表达条件优化,诱导条件优化等可以有效增加蛋白的可溶性比率及表达量。
1. 密码子优化
密码子优化是根据大肠对密码子的偏好性进行优化筛选,一般选择使用频率大于20%的密码子。经过优化的基因序列能提高mRNA二级结构的稳定性,避免因为不充足的tRNA库导致翻译延迟,成熟前翻译终止,翻译移码和氨基酸错配。
2. 降低蛋白表达速率
通过降低IPTG的诱导浓度,降低蛋白的表达速率。通过调节促使肽链聚集的速率与其折叠速率平衡,有利于提高蛋白的可溶性表达。
3. 温度
37度的表达条件往往会使一些蛋白形成包涵体,而30度的表达条件则可能产生可溶的或者有活性的蛋白。在某些条件下(12-20度)延长诱导时间(过夜)会使溶解性蛋白的产量达到最大。
4. 细胞周质表达
我们可以选用一些将蛋白运输到细胞周质的载体。周质空间更有利于蛋白的正确折叠及二硫键的形成。常规选用的载体有pet22系列。但是我们要注意的是,有些蛋白并不适合于被运输到周质空间,比如一些与β-gal融合的周质的内部被证明是有毒的。

上海泽叶生物科技有限公司
实名认证
钻石会员
入驻年限:9年