产品详情
文献和实验
相关推荐
提供商 :研载生物科技
服务名称 :铁死亡(Ferroptosis)
一、铁死亡简介
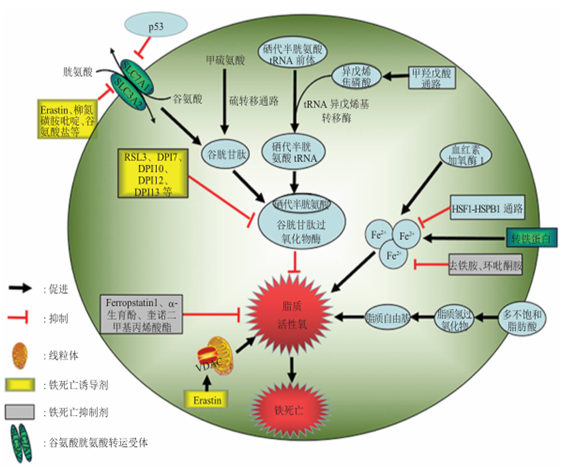
铁死亡(Ferroptosis)最早是2012年由Brent R. Stockwell提出的[1],研究发现Erastin可以特异性诱导Ras突变细胞死亡,但是没有典型的细胞凋亡特征,铁螯合剂可以抑制这一过程,并且另一种化合物RSL3也有类似的细胞死亡表型[2, 3]。与经典的细胞凋亡不同,铁死亡过程中没有细胞皱缩,染色质凝集等现象,但会出现线粒体皱缩,脂质过氧化增加。传统的细胞凋亡,细胞自噬,细胞焦亡的抑制剂不能抑制铁死亡过程,但铁离子螯合剂可以抑制这一过程,说明铁死亡是铁离子依赖的过程。
基础研究中经常涉及到对多种细胞死亡方式的研究,如细胞自噬、凋亡、焦亡等。细胞铁死亡是最近几年才被发现的一种细胞死亡方式,目前对它的形态学、生物学、机制通路有了部分了解,但铁死亡过程涉及多种机制,受到信号通路的精密调控,铁死亡与疾病的发生有何种联系,是否与其他细胞死亡方式联合介导疾病的进展,因此,进一步深入研究铁死亡的作用机理,研究其在不同疾病类型中的作用,对寻找相关疾病的治疗靶点、靶向药物的研发具有重要意义。铁死亡相关特征
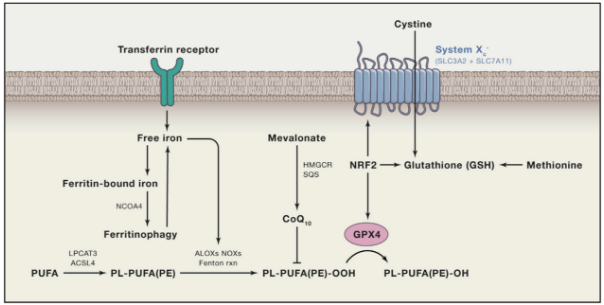
(1)形态学特征:超微结构显示,铁死亡时细胞膜断裂和出泡,线粒体萎缩、线粒体脊减少甚至消失、膜密度增加、细胞核形态正常,但缺乏染色质凝集;电镜下观察到胞内线粒体变小、双层膜密度增高。(2)生物学特征:活性氧(ROS)增加、铁离子聚集,激活丝裂原活化蛋白激酶(MAPK)系统,通过降低胱氨酸的摄取、耗竭谷胱甘肽,抑制ystem Xc-和增加还原型酰腺嘌呤二核苷酸磷酸氧化酶,释放花生四烯酸等介质。
(3)免疫学特征为损伤相关分子模式(damage-associatedmolecular patterns molecules,DAMPs)释放前炎症介质(如高迁移率族蛋白B1等)。
(4)基因水平:主要受核糖体蛋白L8(ribosomalprotein L8,RPL8),铁反应元件结合蛋白(ironresponse element binding protein 2,IREB2),ATP合成酶F0复合体亚基C3(ATP synthase F0 complex subunit C3,ATP5G3),三四肽重复结构域35(tetratricopeptide repeat domain 35,TTC35),柠檬酸合成酶(citratesynthase,CS),酰基辅酶A合成酶家族成员2(acyl-CoAsynthetase family member 2,ACSF2)以及受代谢、储存基因TFRC、ISCU、FTH1、FTL、SLC11A2的调节。
铁死亡的实质是细胞内脂质氧化物代谢障碍,在铁离子催化作用下代谢发生异常,当细胞抗氧化能力减弱,脂质活性氧堆积,使细胞内氧化还原失衡,诱导细胞死亡。
二、铁死亡机制
(1)抑制GPX4诱导铁死亡:GPX4 能降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化。研究发现,若细胞中 GPX4 表达下调则会对铁死亡更敏感;相反,若上调 GPX4 的表达,则会产生对铁死亡的耐受。因此,将GPX4抑制后将诱导细胞发生铁死亡。(2)抑制胱氨酸谷氨酸转运受体 (systemXC-)诱导铁死亡:通过systemXC-,谷氨酸与胱氨酸以1:1比例交换,因此,谷氨酸的水平会影响到systemXC- 的功能。细胞外高浓度的谷氨酸会抑制systemXC-从而诱导铁死亡。敲除systemXC-的小鼠由于细胞外谷氨酸水平减少,可以防止神经毒性损伤。
(3)p53介导铁死亡:p53是一种抑癌基因,通过下调systemXC-组分SLC7A11的表达抑制细胞对胱氨酸的摄取,导致谷胱甘肽过氧化物酶活性降低,削减细胞抗氧化能力,增强细胞对铁死亡的敏感性。同时,研究发现,在人肿瘤细胞中SLC7A11过度表达,这种过表达能够抑制活性氧诱导的“铁死亡”,同时削弱p53 3KR介导的对肿瘤生长的抑制作用。
三、检测方法
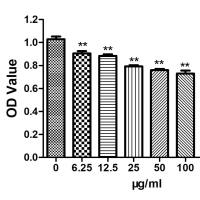
1、新陈代谢(1)细胞活性:CCK-8;
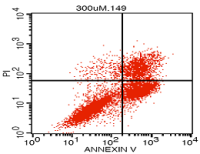
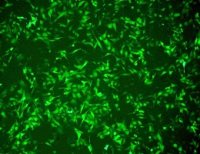
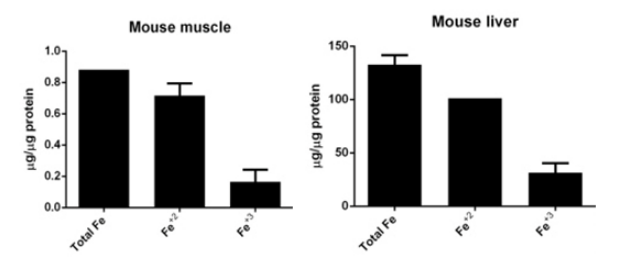
(2)铁水平检测:细胞内可以使用PGSK探针,流式细胞术或共聚焦显微镜检测细胞内铁含量的细胞膜透性染料,结果表明,在铁死亡的细胞中,PGSK的绿色荧光会减弱;或者使用Iron Assay Kit检测细胞、组织中的铁水平;
(3)活性氧水平:细胞内活性氧和脂质活性氧通过流式细胞术使用DCFH-DA(表达上调)或C11-BODIPY 荧光探针检测(在铁死亡细胞中,探针会由红色转化为绿色);
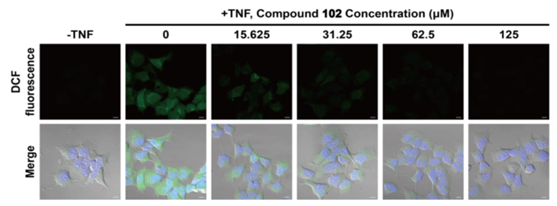
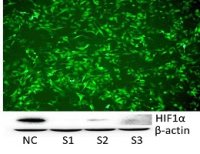
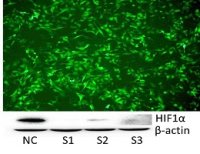
(4)qRT-PCR/WB检测:检测与铁死亡相关的蛋白表达,如PTGS2、NOX1、FTH1、COX2、GPX4、ACSL4等,其中COX2、ACSL4、PTGS2、NOX1在铁死亡细胞中表达上调,GPX4、FTH1在铁死亡细胞中表达下调;

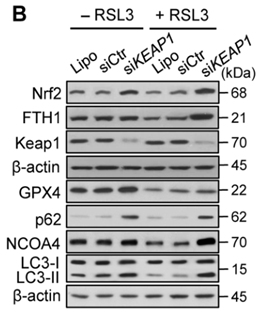
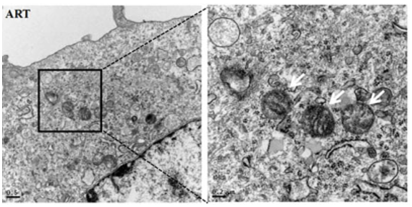
2、形态观察
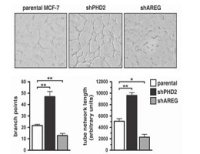
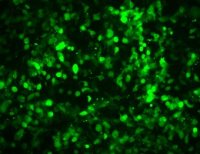
(1)透射电镜直接观察细胞形态:细胞发生铁死亡时线粒体变小以及线粒体膜密度较大;

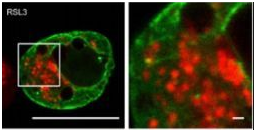
(2)线粒体观察:向细胞内转染LifeAct-GFP荧光蛋白,一段时间后用有丝分裂追踪器观察线粒体形态;

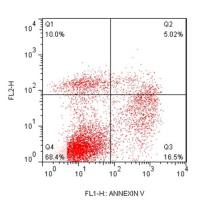
(3)线粒体膜电位检测:通过流式细胞仪收集TMRE阳性细胞的比例。
常用铁死亡研究常用试剂:
(1)System Xc抑制剂,Erastin 及其类似物 sulfasalazine, glutamate, and sorafenib
(2)GPX4 抑制剂,如RSL3,ML162
(3)FIN56可耗尽GPX4和CoQ10
(4)FINO2可间接抑制GPX4,诱导脂质过氧化
四、铁死亡与疾病的关系
1、铁死亡与肿瘤
铁死亡在有关肿瘤的研究中成为近几年的热点之一。通过提高erastin衍生物的溶解度、分离度以及效价,其中的某些衍生物在异种移植肿瘤中已经初见成效。纳米颗粒诱导铁死亡也在异种移植研究中得到了证实。肿瘤抑癌基因p53能抑制 SLC7A11(systemXC-的组成部分),在某些情况下也能够诱导铁死亡的发生;核转录因子Nrf2能抑制肝细胞癌中铁死亡的发生;抑制Nrf2的表达能增强细胞铁死亡。2、铁死亡与帕金森
最近研究证明,铁死亡很有可能是引起PD神经退行性变细胞死亡的通路之一,铁是治疗PD的有效靶点。在细胞和MPTP诱导的PD小鼠模型中运用铁螯合剂(去铁酮),能减少氧化应激,增强多巴胺可利用性,从而改善现有的运动症状和减少运动功能的退化。早期阶段的PD患者中,应用去铁酮治疗可减缓运动缺陷的进展,减少现有的运动症状。在MPTP治疗前24小时给小鼠注射铁死亡抑制剂ferrostatin-1可显著挽救行为障碍和神经元丢失,这表明常见的PD毒素在动物模型中引起神经退行性变的机制可能是铁死亡。

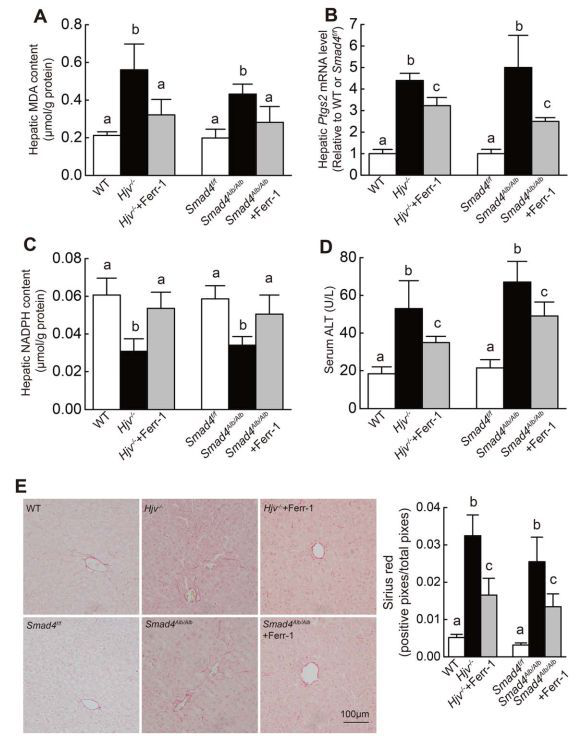
3、细胞铁死亡与肝脏损伤的关系
该研究运用多种基因敲除小鼠模型,首次发现高铁状态以及遗传性血色病铁过载可诱发肝脏(肝细胞及巨噬细胞)发生铁死亡,并且揭示了转运蛋白Slc7a11调控铁死亡的新机制,为肝脏损伤及血色病等系列重大疾病的防治提供了新思路。
参考文献
1. Dixon, S.J., et al., Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 2012. 149(5): p. 1060-72.
2. Yang, W.S. and B.R. Stockwell, Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells. Chem Biol, 2008. 15(3): p. 234-45.
3. Yagoda, N., et al., RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels. Nature, 2007. 447(7146): p. 864-8.
4. Stockwell, B.R., et al., Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell, 2017. 171(2): p. 273-285.

研载生物科技(上海)有限公司
实名认证
钻石会员
入驻年限:7年