产品详情
文献和实验
相关推荐
提供商 :表观生物
服务名称 :翻译组学Ribo-seq ribosome profiling

项目简介
蛋白质是生命活动的主要承担者。根据中心法则,从基因组生成整个蛋白质组需要有RNA生成调控(含表观遗传调控和转录调控)、RNA降解调控、蛋白质生成调控(即翻译调 控)、蛋白质降解调控这四个主要调控阶段。其中, 翻译调控占所有调控比例的一半以上,超过其他所有调控的总和,是细胞内最重要的调控方式[1]。翻译组学针对的是对生命过程全局性研究的主要矛盾,从翻译组学的角度研究问题,可谓是研究中心法则的生物核心信息流。
Ribo-seq (Ribosome profiling),即核糖体印迹测序技术,系由Weissman课题组于2009年首次发表的翻译组学研究技术[2]。利用Ribo-seq,研究者能从基因组水平检测蛋白质的翻译状况,获得全面的、高质量的蛋白质翻译速度情况,了解蛋白质表达情况及其丰度;还能直接对翻译过程进行研究。
技术原理
利用低浓度RNase处理核糖体—新生肽链复合物,降解没有核糖体覆盖的mRNA片段,随后再去除核糖体,通过二代测序技术检测被核糖体保护的约22~30 bp的RNA小片段 (称为ribosome footprints,RFPs;又称ribosome protected fragments,RPFs。两者等价),可得到核糖体分布的位置信息,据此可得到每种转录本上核糖体的分布、密度,可推测起始密码子位置(包括非ATG起始)、ORF(开放阅读框)位置、翻译暂停区域以及uORFs (上游开放阅读框)等信息[3]。

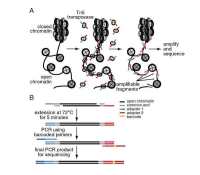
图1. Ribo-seq实验流程图[4]
首先,用翻译抑制剂或液氮急冻处理细胞或组织。核酸酶处理,使不受保护的RNA降解。回收核糖体,通过序列大小选择性回收RFP片段,然后制备文库,进行二代测序。将reads与基因组比对,找到它们在核糖体的位置。

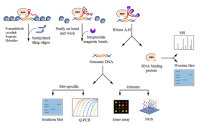
图2. Ribo-seq检测翻译延长速率的原理[4]
(A) 翻译延长速率越慢,核糖体停留的时间越多;(B)细胞内所有组装好的核糖体的“快照”(snapshot);(C)核糖体足迹(footprints)密度越高的位点,表明翻译延长速率越慢。
技术应用
联合longRNA-seq,研究转录本上正在进行的翻译情况,深入了解基因调控最重要层面:
● 了解转录本上的核糖体分布、翻译活性
● 推测翻译起始位点、ORF位置
● 确定蛋白翻译效率
● 探究翻译调控和基因表达情况
● 鉴定具有翻译能力的 lncRNA 和 circRNA
送样要求
样本类型:1. 活细胞样本,密度≥1×107 ;
2. 组织样本,质量≥300mg。
样本物种:仅限人、大小鼠,其他物种需评估。
样品分组
1. 常规要求至少2组样品,包括对照组和实验组(临床样本为正常人组和患者组)。
2. 每个样品均进行 Ribo-seq 和 longRNA-seq (采用去rRNA建库法)。
3. 样本数建议:3 VS 3。
测序方案
1. 测序平台:Illumina NextSeq CN500/NovaSeq 6000
2. 测序模式:SE 75
3. 测序数据量: 40M
分析内容

实测数据及分析结果示例
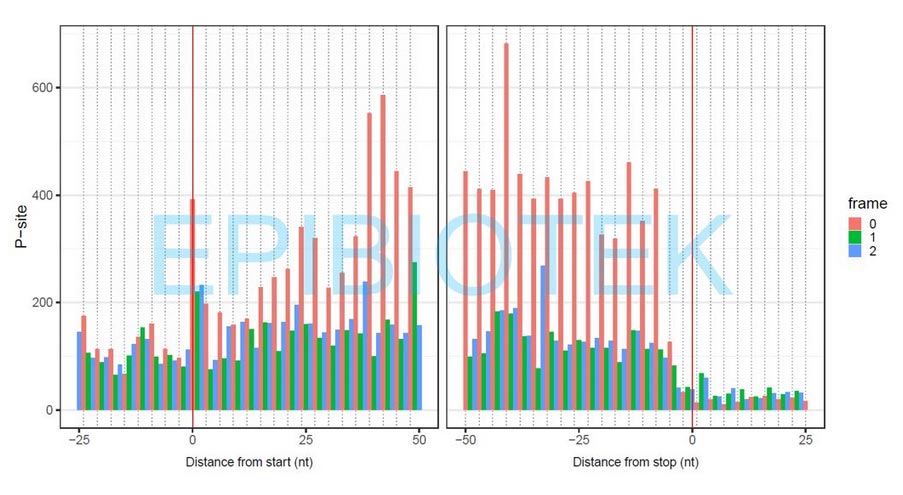 图1. 表观生物通过K562细胞 Ribo-seq,下机质控数据显示具有显著的3nt周期特征,数据质量优异。
图1. 表观生物通过K562细胞 Ribo-seq,下机质控数据显示具有显著的3nt周期特征,数据质量优异。

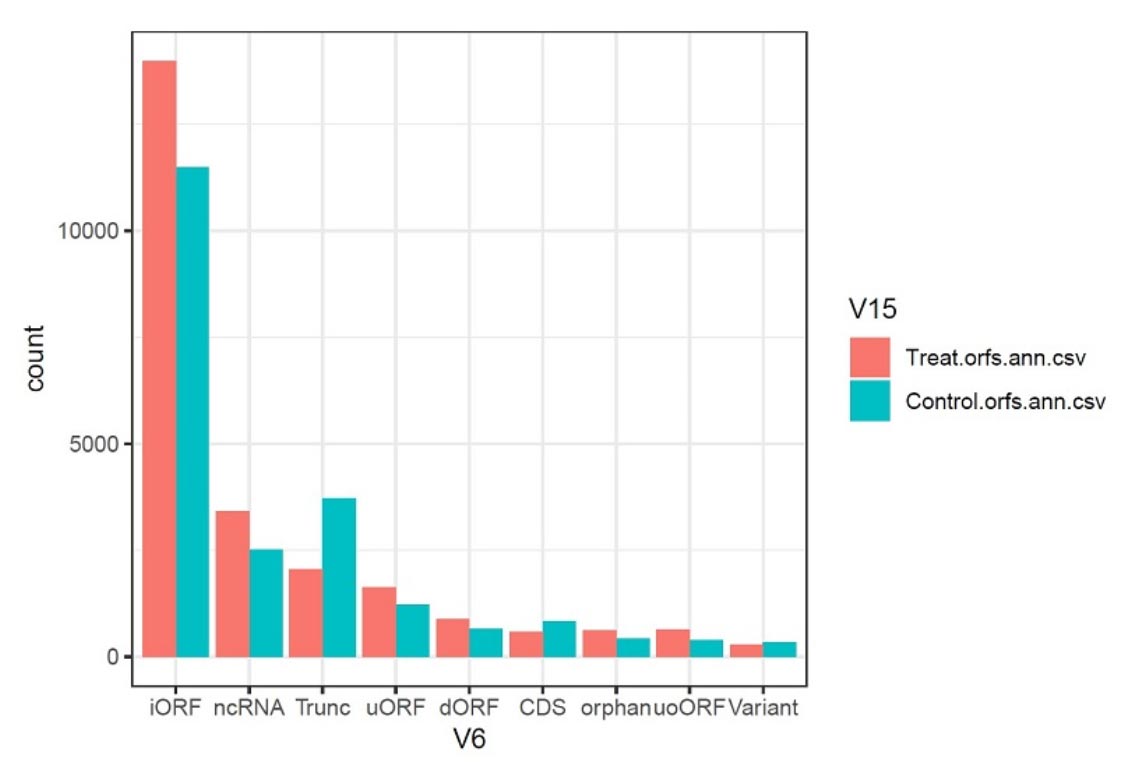
图2. ORF类型分布图


图3. 翻译效率累积分布曲线

图4. 密码子使用频率分布图

图5. 肿瘤新生抗原分析预测(图片来自Genocea poster)
案例:Cell—特异tRNA促进肿瘤转移[5]
该研究发现,在人类乳腺癌中,特殊的tRNAs:tRNAGluUUC 和tRNAArgCCG的表达水平上升会使细胞获得转移能力。研究者通过Ribo-seq检测这些特殊tRNAs增多后转录本上的核糖体结合情况,结果显示富集这些tRNA同源密码子的转录本更加稳定,核糖体结合更多。特别是tRNAGluUUC通过直接增强EXOSC2表达与增强GRIPAP1来构成一条受tRNA驱使的“可诱导”通路,从而促进癌症转移。
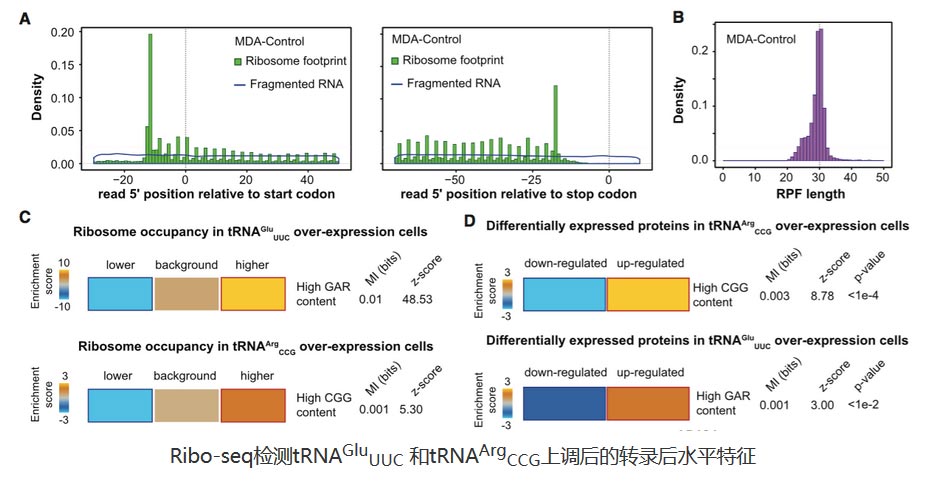
Ribo-seq检测tRNAGluUUC 和tRNAArgCCG上调后的转录后水平特征
参考文献
[1] Schwanhausser B, Busse D, Li N, et al. Global quanti- fication of mammalian gene expression control. Nature, 2011, 473(7347): 337-342
[2] Ingolia NT, Ghaemmaghami S, Newman JR, et al. Ge- nome-wide analysis in vivo of translation with nucleo- tide resolution using ribosome profiling. Science, 2009, 324(5924): 218-223
[3] Ingolia NT. Ribosome Footprint Profiling of Translation throughout the Genome. Cell, 2016, 165(1): 22-33
[4] Gobet C, Naef F. Ribosome profiling and dynamic regulation of translation in mammals. Curr Opin Genet Dev. 2017 Apr;43:120-127.
[5] Goodarzi H, Nguyen H C B, Zhang S, et al. Modulated Expression of Specific tRNAs Drives Gene Expression and Cancer Progression[J]. Cell, 2016, 165(6): 1416-1427.

广州表观生物科技有限公司
实名认证
钻石会员
入驻年限:9年