产品详情
文献和实验
相关推荐
提供商 :维通达
服务名称 :肿瘤免疫小鼠模型
免费福利:关于「小鼠实验」问题的,统统免费答疑!做过小鼠
做过小鼠实验的各位,一定对小鼠实验过程中频频出现的问题烦恼不已
实验小鼠品系繁多,该如何选择?
实验小鼠忽然得病了该怎么办?
母鼠把小鼠吃了,如何避免?
还有各种花式注射方式,玻璃体腔注射、乳腺皮下注射、鞘内注射、无创气管注射。。。。
该选择哪种方式,如果操作?
点击「在线询价」留言问题即可
我们的优势
• 具备分子生物学实验室、显微操作室、万级净化细胞间到SPF动物房,可以灵活地为客户量身订做服务。
• 已经建立了打靶ES细胞库(约2000种),质粒库,细胞库,小鼠胚胎库和精子库(约750种)。
• 公司拥有自建的,经验证具有高效种系传递能力的C57BL/6背景的ES细胞系和iPS细胞系。
发表的文章
1. Simple and efficient production of mice derived from embryonic stem cells aggregated with tetraploid embryos. Li X, Yu Y, Wei W, et al. Mol Reprod Dev. 2005 Jun;71(2):154-8.
2. The proteasomal inhibitor MG132 increases the efficiency of mouse embryo production after cloning by electrofusion. Yu Y, Yong J, Li X, et al. Reproduction. 2005 Oct;130(4):553-8.
3. NestinnegCD24low/- population from fetal Nestin-EGFP transgenic mice enriches the pancreatic endocrine progenitor cells. Wang X, Hu J, Zhao D, et al. Ding M. Pancreas. 2005 Nov;31(4):385-91.
4. Live offspring produced by mouse oocytes derived from premeiotic fetal germ cells. Shen W, Zhang D, Qing T, et al. Biol Reprod. 2006 Oct;75(4):615-23. Epub 2006 May 24.
5. Mouse oocytes derived from fetal germ cells are competent to support the development of embryos by in vitro fertilization. Shen W, Li L, Zhang D, et al. Mol Reprod Dev. 2006 Oct;73(10):1312-7. Erratum in: Mol Reprod Dev. 2008 Nov;75(11):1688-9.
6. Serial nuclear transfer improves the developmental potential of mouse embryos cloned from oocytes matured in a protein-free medium. Bai Z, Yong J, Qing T, et al. Mol Reprod Dev. 2007 May;74(5):560-7.
7. Identification and characterization of label-retaining cells in mouse pancreas. Teng C, Guo Y, Zhang H, et al. Differentiation. 2007 Oct;75(8):702-12. Epub 2007 Mar 23.
8. Induction of oocyte-like cells from mouse embryonic stem cells by co-culture with ovarian granulosa cells. Qing T, Shi Y, Qin H, et al. Differentiation. 2007 Dec;75(10):902-11. Epub 2007 May 9.
9. In vitro development of mouse fetal germ cells into mature oocytes. Shen W, Li L, Bai Z, Pan Q, et al. Reproduction. 2007 Aug;134(2):223-31.
10. Mature oocytes derived from purified mouse fetal germ cells. Qing T, Liu H, Wei W, et al. Hum Reprod. 2008 Jan;23(1):54-61. Epub 2007 Nov 13.
11. A human endothelial cell feeder system that efficiently supports the undifferentiated growth of mouse embryonic stem cells. Zhou H, Yong J, Sun X, et al. .Differentiation. 2008 Nov;76(9):923-30. doi: 10.1111/j.1432-0436.2008.00280.x. Epub 2008 Jun 13.
12. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Yang W, Wei W, Shi C, et al. Stem Cells. 2009 Feb;27(2):383-9. doi: 10.1634/stemcells.2008-0974.
13. Pancreas-specific Pten deficiency causes partial resistance to diabetes and elevated hepatic AKT signaling. Tong Z, Fan Y, Zhang W, et al. Cell Res. 2009 Jun;19(6):710-9. doi: 10.1038/cr.2009.42.
14. A mouse model of inducible liver injury caused by tet-on regulated urokinase for studies of hepatocyte transplantation. Song X, Guo Y, Duo S, et al. Am J Pathol. 2009 Nov;175(5):1975-83. doi: 10.2353/ajpath.2009.090349. Epub 2009 Oct 1.
15. P21cip-overexpression in the mouse beta cells leads to the improved recovery from streptozotocin-induced diabetes. Yang J, Zhang W, Jiang W, S et al. PLoS One. 2009 Dec 17;4(12):e8344. doi: 10.1371/journal.pone.0008344.
16. Generation of iPSCs from mouse fibroblasts with a single gene, Oct4, and small molecules. Li Y, Zhang Q, Yin X, et al. Cell Res. 2011 Jan;21(1):196-204. doi: 10.1038/cr.2010.142. Epub 2010 Oct 19.
17. Overexpression of eIF-5A2 in mice causes accelerated organismal aging by increasing chromosome instability. Chen M, Huang JD, Deng HK, et al. BMC Cancer. 2011 May 26;11:199. doi: 10.1186/1471-2407-11-199.
18. The heterogeneity and dynamic equilibrium of rat embryonic stem cells. Shen Y, Shi C, Wei W, et al. Cell Res. 2011 Jul;21(7):1143-7. doi: 10.1038/cr.2011.98. Epub 2011 Jun 14.
19. Induction of pluripotency in mouse somatic cells with lineage specifiers. Shu J, Wu C, Wu Y, et al. Cell. 2013 May 23;153(5):963-75. doi: 10.1016/j.cell.2013.05.001.
20. Pluripotent Stem Cells Induced from Mouse Somatic Cells by Small-Molecule Compounds
2013 年《Science》杂志评选的当年十大科学突破中,癌症免疫治疗研究成果位列其首!
2018 年的诺贝尔生理医学奖授予了开启肿瘤免疫治疗新航向的美国免疫学家詹姆斯 · 艾利森(James P. Allision)和日本教授本庶佑(Tasuku Honjo)!
自此,人类与癌症的斗争进入肿瘤 - 免疫(immuno-oncology,IO)时代!
以免疫检查点(immune checkpoint)抑制剂和 CAR-T 细胞治疗为代表的新的免疫疗法在临床实践中创造的许多奇迹!
这些研究让人们相信癌症不再是不治之症!
虽然癌症的免疫治疗研究方兴未艾,但其实人们很早就认识到免疫与肿瘤的密切关系:
1. 某些肿瘤的发生由慢性炎症而起;
2. 肿瘤的发展、转移需要逃脱免疫系统的严密监视;
3. 免疫细胞是构成肿瘤生长微环境的重要组分,某些免疫反应会被肿瘤细胞利用而成为促进肿瘤生长、扩散的因素,有可能在肿瘤治疗,尤其是免疫治疗当中发挥负面影响。
因此免疫与肿瘤的关系研究,特别是肿瘤微环境中的免疫调节机制的研究也成为当今 IO 时代的重要内涵。不管是癌症免疫治疗还是肿瘤发生发展、肿瘤微环境的机理研究,这些复杂的、系统性的研究当然都离不开动物模型的应用。在此就一一细数 IO 研究中用到的小鼠模型,全是干货哦~
图片来源:站酷海洛
1. 自发、诱导的小鼠肿瘤及其移植瘤模型
正常的小鼠在大约一年半的生命周期里也有可能罹患癌症,不同品系的小鼠自发肿瘤的几率和类型不同,体现出遗传因素与癌症易感性的关联。为了更有效地获得小鼠肿瘤模型,也可以采用人为的物理(如紫外线、放射线照射)、化学(天然致癌物质和致癌化合物)和生物(病毒等)的方法诱导小鼠产生肿瘤。可以诱导小鼠肿瘤的致癌物有多环芳烃类、亚硝胺类、偶氮染料类、黄曲霉毒素等。实验室常用的诱导化合物包括 MNU(N - 甲基 - 亚硝-基脲)、DEN(二乙基亚硝胺)、4NQO(4 - 硝基喹-啉 - 1 - 氧化物)等,可诱导小鼠发生肝癌、食管癌、肺癌、膀胱癌等多种肿瘤,为癌症发生的机理研究提供了有用模型。
研究者也从小鼠的肿瘤建立起很多可在体外培养传代的肿瘤细胞系,如结肠癌细胞 CT26-WT、黑色素瘤细胞 B16,肝细胞癌细胞 H22,淋巴瘤细胞 A20 等,这些肿瘤细胞系不仅为癌细胞的体外生物学研究提供了工具,而且可以移植到遗传背景相同、不会发生免疫排斥的其它小鼠体内,建立移植瘤小鼠模型。小鼠自发或诱发的肿瘤也可以剖取下来,分割为小组织块,移植到其它小鼠体内,制作成异体移植瘤模型(allograft)。对于近交系小鼠品系建立的异体肿瘤移植模型,由于小鼠之间的遗传背景相同,其实相当于自体移植(autograft),又可称为同基因型(syngeneic)肿瘤移植模型。移植瘤模型由于可以大量制备,荷瘤鼠之间均一性好,因而非常适合抗肿瘤药物筛选和评价的体内实验。因为荷瘤鼠体内有着正常的免疫系统,这种模型可以用来研究肿瘤和免疫系统的相互作用,也可以进行一些肿瘤免疫治疗的概念性(proof of concept)、机理性(mechanism)研究。
2. 基因工程小鼠肿瘤模型
自发或诱导肿瘤模型都带有相当的随机性、不确定性,产生的肿瘤类型、特征也经常不能满足研究的需要。随着基因工程技术的发展成熟,对小鼠进行遗传修饰—包括转入新基因、删除基因、基因替换等成为可能。
研究发现,在小鼠上过表达某些致癌基因或者敲除某些抑癌基因可以导致小鼠易发肿瘤。于是利用基因工程手段来研发各类小鼠肿瘤模型的工作越来越多。比如 p53 基因敲除的小鼠,纯合体一般在 3、4 个月内发生各类肿瘤,杂合体在 6 个月之后也多发肿瘤。组织特异性地敲除 Pten 基因,则导致这种特定的组织中高发肿瘤。过表达 Ras、Myc 等这些癌基因的转基因鼠也易发各种肿瘤。人们可以把在临床研究中发现的与肿瘤相关的基因突变通过基因工程手段,如转基因、基因编辑等方法复现在小鼠基因组上,验证这种突变的致癌作用,以及探寻该种基因突变驱动的肿瘤的生物标志物(Biomarker)、诊断和治疗方法等。
基因修饰小鼠模型(genetically engineered mouse model, GEMM)产生的肿瘤也可以移植到相同遗传背景的其它小鼠体内,建立异体移植瘤模型,这被称为 GDA( GEM-derived allograft)模型。
这里有个非常好的栗子:
GEM 肿瘤模型的例子即 KPC(LSL-KrasG12D/+; LSL-Trp53R172H/+; Pdx-1-Cre)小鼠。 KrasG12D 是人类肿瘤中常见的 Kras 基因的活化突变体,Trp53R172H 则是 p53 基因的突变体。在这两个基因编码区和启动子之间插入 loxp-Stop-loxp 序列,然后将这两个基因构件转入小鼠基因组,制作出双转基因小鼠。由于「Stop」序列的存在,这两个基因并不会被转录。当双转基因小鼠再与 Pdx-Cre 小鼠配在一起,Pdx 驱动表达元件使 Cre 重组酶得以在胰腺组织特异表达,切除一对 loxp 之间的「Stop」序列,KrasG12D 和 Trp53G12D 基因开始表达,其结果是小鼠在 2、3 个月内几乎都有胰腺肿瘤发生,并有肿瘤转移现象。KPC 小鼠为胰腺癌这一癌症之-王的研究提供了绝好的研究工具。
3. 分子嵌合小鼠肿瘤模型
小鼠模型虽然可以为人类肿瘤的研究提供有用工具,但有时并不理想,因为毕竟人和小鼠在遗传、生理 / 病理方面存在着巨大差异。对于 IO 研究,肿瘤和免疫系统都可能存在种属差异,生物标志物、抗肿瘤药物靶点、药物反应性、治疗有效性都有不同之处。
通过基因工程的方法,包括经典的转基因技术、基于胚胎干细胞基因打靶的基因敲出 / 敲入技术以及新兴的基因编辑技术将人源基因导入小鼠基因组,可以建立基因「人源化」小鼠。这种小鼠体内表达某种研究者感兴趣的人特有的蛋白,成为在分子水平上的人鼠嵌合体。这种人源化可以遗传给后代,使其成为有特殊用途的新品系小鼠。基因人源化小鼠在许多领域得到应用,包括肿瘤免疫治疗研究。
免疫检查点(immune checkpoint)是近年来发现的利用自身免疫功能抗肿瘤的重要药物靶点。针对 PD1/PDL1 这一对 「免疫刹车」信号分子的单抗药物已被证明具有强大的抗肿瘤效用。由于这些抗体药物都是针对人的靶点设计和筛选的,它可能只识别、结合人的 PD1、PDL1,就无法用动物做临床前体内评估实验。
为了解决这个问题,可以通过基因编辑技术将小鼠的 PD1、PDL1 基因替换为人的基因,这样小鼠的细胞上就表达人的 PD1、PDL1,可以用来试验抗人 PD1、PDL1 抗体药的作用。在做基因编辑的设计时,为了保证这些信号分子与小鼠细胞内信号转导分子之间的相互作用正常进行,一般只替换蛋白分子的胞外区基因片段,使其表达人的抗原靶位,而保持小鼠源的胞内区。
以人源化 PD1 小鼠的应用为例,评价抗 PD1 抗体药的抗肿瘤效果时,先在这种小鼠上接种一个表达 PDL-1(这个分子在人鼠之间同源性较高) 的同背景肿瘤细胞(如小鼠结肠癌细胞系 MC38),然后就可以用荷瘤模型给药来评估有无抑制肿瘤的效果。如果药物可以阻断 PD1/PDL1 之间的结合,解除免疫抑制,免疫系统活化,重新开始攻击肿瘤,就可以观察到小鼠肿瘤的生长抑制或消退。
基因人源化小鼠应用于肿瘤免疫治疗研究的另一个例子是在双特异性抗体(bispecific antibodies)的体内筛选、评估试验中。有一大类抗肿瘤双特异性抗体药的设计原理是它既可以结合一种人的肿瘤抗原,又可以结合人的 T 淋巴细胞上的 CD3 分子,这样双特异性抗体可以把 T 细胞连接到肿瘤细胞上,同时激活 T 细胞,从而来攻击杀伤肿瘤。由于肿瘤抗原、CD3 分子这两个靶点都是人的,在普通小鼠模型上无法评价这类双特异性抗体。一般 CD3 上的靶点在其ε亚基上,因此可以将 CD3E 基因人源化,然后在其 T 细胞上表达人 CD3E 的小鼠上接种表达有人的特定肿瘤抗原的小鼠肿瘤细胞,这个体系就可以用来测试评估双特异性抗体的抗肿瘤效果。
4. 人源肿瘤小鼠移植模型
将人的肿瘤移植给小鼠,可以建立人源化肿瘤小鼠模型,前提是小鼠受体必须是免疫缺陷的,否则将被免疫排斥。最早的人源肿瘤模型在裸鼠上建立成功。裸鼠为先天性无胸腺的小鼠品系,体内缺乏 T 淋巴细胞。这说明 T 细胞在异种排斥中起着至关重要的作用。后来发现在免疫缺陷程度更高的小鼠上人源肿瘤更易生长,如 T、B 淋巴细胞联合缺失的 scid 小鼠、Rag1/Rag2 敲除小鼠等。
图片来源:站酷海洛
目前,最为广泛使用的作为人源化受体的高度免疫缺陷小鼠品系是 NOD prkdcscidIl2rgnull 小鼠,即非肥胖型糖尿病小鼠 NOD 遗传背景,SCID 基因突变,Il2 受体的 gamma 链亚基敲除的小鼠,由日本的 CIEA 研发的被称为 NOG,由美国 Jackson Laboratory 研发的被称为 NSG,由北京维通达公司生物技术公司研发的被称为 NPG。此类小鼠之所以被选择,是因为:
(1)NOD 背景的小鼠存在许多先天性免疫功能的缺陷,如巨噬细胞对人源细胞吞噬能力弱(由于其不同于其它品系小鼠和更接近人的 Sirpα分子的结构);补体系统缺失;树突状细胞功能弱等。
(2)prkdc 基因在 B 细胞抗体基因重排及 T 细胞受体基因重排过程中均发挥不可替代作用,这个基因突变导致 T 细胞、B 细胞发育阻滞,使机体细胞免疫、体液免疫功能联合缺失。
(3)Il2rg 基因是多种白介素受体的共同亚基,它缺失后多种免疫功能受损,尤其是 NK 细胞活性完全丧失。这些特点结合在一起,使 NPG 类小鼠成为迄今为止免疫功能缺失最严重,最适合接受人源细胞移植的小鼠品系。
人源肿瘤移植模型可以分为 CDX(cell line derived xenograft)模型和 PDX(patient derived xenograft)模型,前者是由已经建立的各种肿瘤细胞系接种小鼠,后者是由临床获得的病人的肿瘤组织直接移植给小鼠建立肿瘤模型。PDX 模型因为更多的保留着病人肿瘤的「原生态」,包括肿瘤细胞的异质性、肿瘤的微环境,因而更具有临床相关性。CDX 模型的特点则是容易获得,永久传代,每个细胞系都有较多数据积累,一致性较高,便于多地点比较研究……。
肿瘤模型一般为皮下接种,因皮下瘤便于观察和测量。也可作腹腔内、肾包膜下以及「原位」接种,如肝癌组织细胞接种于肝,血液瘤注射入血液,乳腺癌接种于乳腺管等。原位接种使肿瘤微环境更接近真实,更易发生转移现象。PDX、CDX 肿瘤模型都广泛应用于肿瘤学研究和抗癌药物的体内筛选、评估实验。然而,由于使用免疫缺陷动物建立肿瘤模型,体内没有正常免疫系统,使得这种模型「先天不足」。 免疫细胞是肿瘤微环境中的重要成分,对肿瘤的发生、发展、治疗效果都扮演着至关重要的作用。建立既具有人的免疫系统又有人的肿瘤的动物模型是研究者长久以来的一个追求。
5. 人源免疫系统 - 肿瘤小鼠模型
人源化动物模型(humanized animal model)指携带有人的功能性基因的动物或移植了人的细胞、组织、器官的动物,后者也称嵌合体动物。即人源化包括基因水平的人源化以及组织细胞水平的人源化。导入人源成分之后,就使某些原来只能在人体上进行的体内实验可以在动物上进行,解决了人体实验的伦理诘难。
在 IO 研究当中,如前面讲到,个别或少数基因的人源化小鼠可以在某些方面获得应用,但总体而言实验仍然建立在小鼠的肿瘤和小鼠的免疫系统之上,依然无法反映人体系统的情况和反应。
NPG 这类高度免疫缺陷小鼠的出现,使向小鼠移植人的造血 / 免疫系统成为可能。目前,人源化造血 / 免疫系统小鼠可以归为三大类:移植成体外周血单个核细胞(PBMC)或分离的免疫细胞的模型;移植来自人的脐带血、胎肝的造血干细胞(HSC)的模型;联合移植来自同一供体的胸腺、胎肝、骨髓造血干细胞(Bone、Liver、Thymus-BLT)模型。这些模型各有自身的特点,也各自存在一些不尽人意的缺点(见下表)。
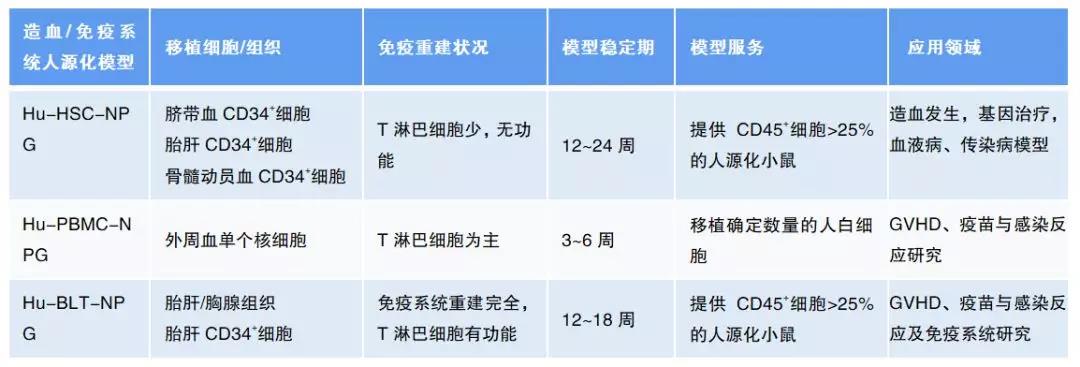
PBMC 移植 NPG 类小鼠建立的模型,因为含有成熟的免疫细胞,因而可以进行某些要求人的免疫功能的体内实验。移植之后这些成熟的免疫细胞中的 T 淋巴细胞会受到小鼠异种抗原刺激而增殖,其它种类细胞则维持较低含量,有的细胞寿命有限而从体内消失。所以 PBMC 移植模型的人源细胞以 T 细胞为主。移植的人源免疫细胞,主要是 T 细胞,还会对受体小鼠产生免疫攻击,发生发生移植物抗宿主反应(GvHD),并在大约数周之后引起小鼠死亡,所以 PBMC 模型可供实验的窗口期较短,只适合于短期性研究。
造血干细胞是所有造血和免疫细胞的共同祖细胞。HSC 移植 NPG 类小鼠之后可以定植于小鼠骨髓,并不断产生各类造血、免疫细胞,如 T 细胞、B 细胞、NK 细胞、髓系细胞等。由于其免疫细胞是在小鼠体内「从头」发育出的,对小鼠宿主产生耐受,所以不出现 GvHD 现象,模型存活一年还可以在血中检测到人源细胞稳定存在。这种模型的缺点是发育出的 T 细胞功能较弱。这是因为 T 细胞需要在胸腺中完成「education」过程,T 细胞受体形成 MHC 限制性。人源 T 细胞的前体在小鼠胸腺内完成发育,可能既表现小鼠 MHC 限制性,也表现 HLA 限制性,造成与人源细胞相互作用类似于异体(allo-)或异种(xeno-)排斥反应。
为了解决 T 细胞在人源化小鼠体内不能正常发育的问题,又发明了 BLT 模型,就是将胎胸腺和胎肝小组织块合并移植到小鼠肾包膜下,再移植分离自同一个体的胎肝或骨髓的造血干细胞。这样人源前体细胞可以迁移到肾包膜下生长的胸腺类器官中发育出自身 MHC 限制性的功能性 T 细胞。BLT 模型被认为是人的免疫功能最完善的人源化小鼠模型。但是,由于 BLT 模型的人源组织材料取自流产胎儿,来源非常有限,且面临很大的伦理争议,因而应用受到限制。
将 PDX/CDX 肿瘤移植模型跟人源化免疫系统模型结合起来可以用于人类肿瘤免疫方面的研究,如 PBMC 模型加肿瘤模型、HSC 模型加肿瘤模型。这些模型已经在肿瘤与免疫系统的相互作用研究以及肿瘤免疫治疗研究当中获得应用,但是也有一些问题未能解决。
PBMC 移植再加肿瘤的模型,因为模型的稳定期短,肿瘤接种时机需要精确把握。更关键的,因为很难获得相同 HLA 配型的 PBMC 和肿瘤,所以 PBMC 对肿瘤存在异体排斥。排斥作用太强则肿瘤不能在模型上生长。所以需要筛选、匹配合适的 PBMC 和肿瘤供体来建立共移植模型。
HSC 移植加肿瘤的模型出现肿瘤被排斥的情况较少,但也需要对 HSC 供者跟肿瘤做一定筛选匹配。HSC 移植加肿瘤的模型作为肿瘤免疫模型有几点必须考虑:
(1)人 T 细胞在小鼠胸腺完成发育,大部分表现小鼠 MHC 限制性,视人 MHC 为异己;
(2)APC 细胞对 T 细胞的「Prime」作用存疑;
(3)T 细胞对人肿瘤的反应类似一种异体 / 异种排斥反应,反应有可能强有可能弱,不能以 HLA 配型与否预测;
(4)T 细胞对肿瘤的反应可能以 CD8 + 细胞毒反应为主。
虽然因为 MHC 匹配问题,HSC 移植模型发育出的 T 细胞功能不太正常,但因为其免疫调控机制很多还是存在的,可以被激活和发挥功能,所以这类模型有可能应用于肿瘤免疫微环境研究、immune checkpoint inhibitor 抗癌药物评价、双特异性抗体抗癌药物评价(不依赖 MHC 识别)、CAR-T 治疗肿瘤的研究(也不依赖 MHC 识别)以及作为因子释放综合征(cytokine release syndrome)模型等等。
不可否认的是现有人源化免疫系统小鼠模型仍然存在诸多缺陷,不能满足肿瘤免疫研究中的需要。为此正在研发下一代的人源化小鼠,包括 MHC 基因人源化小鼠(表达 HLA 的小鼠),转入人源细胞因子如 IL-2、IL-3、GM-CSF、SCF 等以能更好支持功能性免疫细胞发育的小鼠。使用自身 MHC 分子敲除的 NPG 类小鼠制作 PBMC 人源化小鼠则可以延缓 GvHD 的发生,拓展了此类模型应用的窗口期。
北京维通达生物技术有限公司是在国家 863 计划倡导下,为推动我国疾病模型动物的研发和产业化,于 2000 年成立的一家专注于基因修饰和人源化动物模型研发与服务的高科技公司。作为在中国的第一家研发和供应最-高程度免疫缺陷大小鼠模型,以及组织器官人源化模型与服务的公司,目前在三个层面提供肿瘤免疫治疗和肝病两大疾病领域的动物模型及服务:
(1)成熟标准化——各种免疫缺陷程度的小鼠和大鼠模型,畅销国内外数百家生物公司、CRO 和高校、科研院所;
(2)组织器官水平的人源化——功能性人源化免疫系统、人源化肝脏系统、人源化肿瘤模型及服务,为肿瘤免疫治疗和乙型肝炎病毒(HBV)药物提供先进的体内研究和评价平台。
(3)基因水平人源化——通过基因修饰手段定制的各种疾病动物模型,并发表在 Sciences, Cell, Cell stem cell 等多篇高水平国际期刊中。
维通达有一支海归博士和国内知名大学博士领军的技术人才队伍,我们期待利用特色平台和专业化,个性化,精准的服务为更多的疾病领域提供优质特色的动物模型。

北京维通达生物技术有限公司
品牌商实名认证
钻石会员
入驻年限:11年