产品详情
文献和实验
相关推荐
提供商 :上海锐赛生物技术有限公司
服务名称 :shRNA载体构建及筛选服务
实验原理
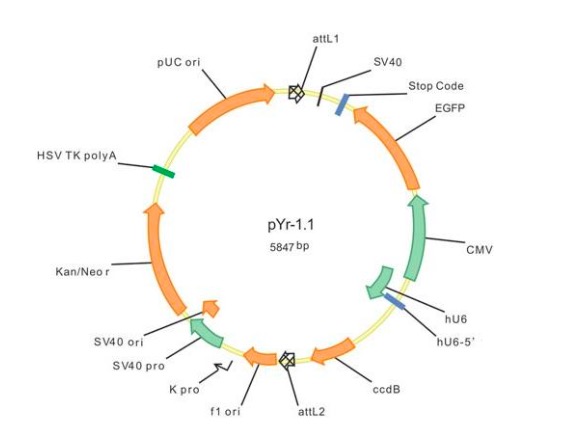
早期的shRNA载体多采用RNA聚合酶III型启动子介导shRNA的表达,RNA聚合酶III型启动子如鼠源的U6启动子和人源的H1启动子可以在哺乳动物细胞中表达小分子RNA。随着miRNA干扰机制的深入研究,发展出第二代siRNA载体,即采用RNA聚合酶II型启动子CMV表达含侧翼序列的miRNA模拟物(见图2.2)。该载体模拟miRNA的加工,表达出来的shRNA进入RISC沉默复合物的效率要比RNA聚合酶III型启动子表达的shRNA高倍十倍,抑制效率更好,且可以和EGP协调表达,方便观察转染效率。

图2.2RNA聚合酶II型启动子pRS/CMV/miR图谱
技术应用
1、基因功能的体内外研究
2、病理机制研究
实验流程

| 实物 | 数据信息 | 实验周期 | |
| 客户提供 | 无 | 目的基因NCBI登录号 | 6周 |
| 我们提供 | shRNA载体/菌株 | 基本实验步骤、细胞照片、 qPCR原始数据,扩增曲线,溶解曲线 |
实验结果展示

图2.3相对定量PCR检测4组shRNA转染组相对阴性对照组目的基因的干扰效果
TROUBLESHOOTLNG
| 实验问题 | 原因 | 推荐解决方法 |
| shRNA转染靶细胞后 qPCR检测干扰效果不佳? |
转染效率低 | 保证细胞状态,选择合适的转染试剂,转染效率要求在80%以上,难以达到要求考虑用慢病毒或腺病毒介导。 |
| 转染条件不佳 | 调整shRNA质粒与转染试剂的比例。 | |
| 本底表达丰度过低 | 本底表达丰度过低干扰效果会很不明显。 | |
| shRNA转染靶细胞后WB 检测干扰效果不佳? |
靶蛋白的稳定性较强 | 延长干扰时间可改用病毒介导或进行稳转筛选。 |
| 使用文献提供靶点无干扰 效果? |
实验无法重复文献结果 | 建议重新设计4个干扰靶点进行最佳靶点的筛选工作。 |
常见问题 FAQ
Q :siRNA,miRNA以及shRNA如何区分?
| 名称 | 特点 |
| siRNA (双链小片段RNA) |
在RNAi通路中起作用,干扰特异基因的表达。 |
| miRNA (单链微小RNA) |
由发夹状结构经酶切后以双链形式存在,最后释放互补链,获得成熟链 后可与mRNA互补下调基因表达。 |
| shRNA (短发夹RNA) |
人工构建至U6/H1或CMV启动子的shRNA载体中,利用细胞内的酶切机制得到siRNA。 |
Q :我只确定了靶基因,没有任何靶点的情况下如何开展RNAi工作?
A :在未知靶点的情况下,我们可以为客户的靶基因设计四个干扰靶点,并进行shRNA干扰载体的构建工作。构建好的干扰载体,常规采用转染效率高的293T细胞进行干扰筛选,若靶基因在293T细胞表达丰度高可直接进行筛选;若靶基因表达丰度过低则需要构建靶基因的真核表达载体与干扰质粒共转染293T细胞后进行筛选。
Q :为何要进行293T细胞中靶基因的表达丰度检测?
A :我们对293T细胞的靶基因表达丰度进行qPCR相对定量分析以确定后续的干扰筛选方式;如果靶基因与内参基因的Ct值小于7则认为表达丰度较高,可以进行293T细胞的内源筛选实验;反之则建议构建真核表达载体与干扰质粒共转染293T细胞后进行筛选。
Q :贵公司能否保证RNAi靶点的干扰效率?
A :针对人、大鼠、小鼠设计的4个干扰靶点中,我们保证在转染效率大于80%的情况下,qPCR检测有1个靶点的干扰效果不小于70%。
Q :不同细胞中表达同一干扰片段对靶基因的沉默效果会有差异吗?
A :会有差异:
1) 干扰片段所对应的目的mRNA的位点上可能有蛋白结合导致干扰片段无法接近目的序列,不同细胞结合蛋白的多少可能不一样从而影响沉默效果。
2) 不同细胞目的mRNA的表达含量不一样可能导致沉默效果会有差异。
3) Dicer、Drosha以及运输RNAi加工中间体出核或者入核的蛋白和RISC复合物表达量会在不同细胞中有所差异。
4) 不同细胞中CMV启动子活性可能不同,导致其表达量会有差异。
Q :可否直接提供靶细胞进行干扰效率筛选工作?
A :目的基因表达丰度高的靶细胞若转染效率可达到80%以上可以进行shRNA质粒的干扰筛选工作,若转染效率过低,则建议在293T细胞中进行筛选,或者包装干扰病毒液感染靶细胞进行筛选工作。
Q :针对人类基因设计的感染靶点对小鼠是否也有效?
A :由于设计好的干扰靶点要求与靶基因序列完全互补配对,故大部分干扰靶点无法满足两个物种基因沉默的效果。即便是针对不同物种的同源基因的相同片段,由于基因在不同物种中表达有差异,也会导致不同的基因沉默效果,因此要进行靶点验证工作。
参考文献
1. 1 Sui G, Soohoo C, Affar EB, et al. A DNA vector-based R N A i technology to suppress gene expression in mammaliancells.Proc. Natl. Acad. Sci. USA 2002,99(8):5515-5520.
2.Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering R NAs in mammsliancells. Science 2002 296(5567):550-553.

上海锐赛生物科技(集团)有限公司
实名认证
金牌会员
入驻年限:15年