实验原理
稳转细胞株是指经合适的药物浓度进行药物筛选后,得到外源DNA稳定整合到宿主染色体,并可以长时间表达外源目的基因的细胞。稳定表达细胞株弥补了瞬时感染(或转染)实验中外源基因表达时间短的缺陷,便于长期观察。稳转细胞的筛选需根据不同基因载体中所含有的抗性标志选用相应的药物,常用的抗性筛选有嘌呤霉素(puromycin)、潮霉素(hygromycin)、新霉素(neomycin)、灭稻瘟素(Blasticidin)等。若实验需求构建稳转细胞株,我们建议通过慢病毒感染细胞进行药物筛选的方法,此方法较质粒转染可以更加有效的将外源基因整合入基因组,且整合位点处于转录相对活跃的区域,从而获得更加高效表达外源基因的稳转株细胞。
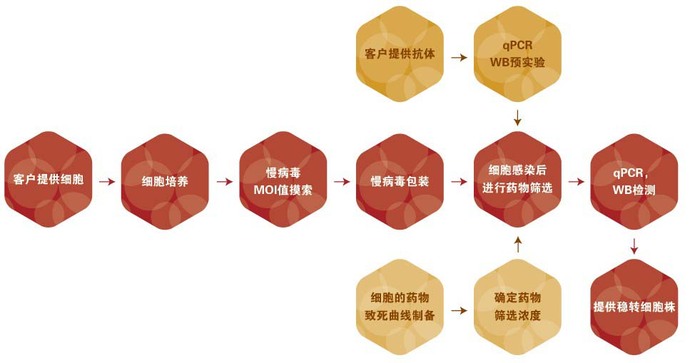
实验流程
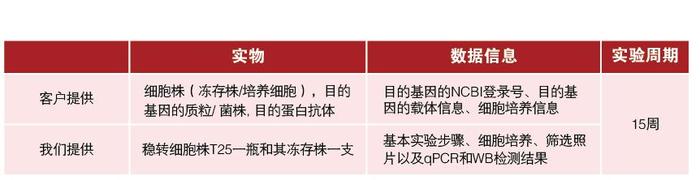
实验结果展示
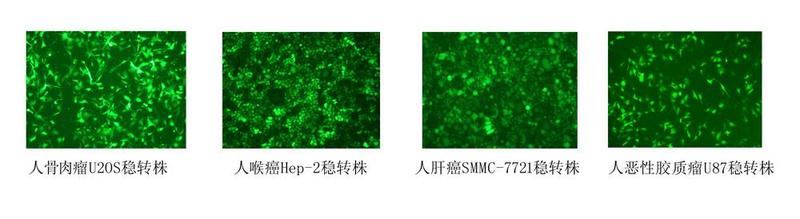
图 1 稳转细胞株成功案例
TROUBLESHOOTING
| 实验问题 |
原因 |
推荐解决方法 |
| GFP阴性对照慢病毒感染细胞无荧光? |
细胞状态不佳 |
细胞状态调整良好且细胞密度合适。 |
| |
病毒感染细胞条件不适合 |
采用梯度浓度的慢性毒感染细胞,摸索合适的病毒感染细胞的比例,并考虑是否加polybrene。 |
| 稳转细胞株状态变差? |
传代次数过多 |
采用10代以内的细胞尽快完成实验,尽量防止反复冻存复苏操作。 |
| 稳转细胞株中表达GFP的细胞变少? |
出现非抗性细胞 |
适当增加抗生素浓度。 |
| 质粒转染细胞效率过低? |
质粒DNA的纯度 |
无内毒素污染的高纯度的质粒。 |
| |
转染试剂 |
选择适合靶细胞的转染试剂并摸索转染试剂与质粒的混合比例。 |
| |
细胞状态 |
细胞状态良好,细胞密度适合。 |
| |
更换基因导入方式 |
更换基因导入方式对于难转染细胞建议采用病毒介导。 |
常见问题 FAQ
Q:外源基因导入哺乳动物细胞的常见方法有哪些?
A:外源基因导入哺乳动物细胞是目前基因治疗的关键步骤,理想的方法应具备如下特点:高效、安全、低细胞毒性且方法简单省时、经济。常见方法及比较请见下表:
| 常见方法 |
原理 |
优缺点 |
| 脂质体转染 |
带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞。 |
最常用的转染方法,体外对部分细胞有很高的效率;在体内迅速被血清清除,会产生一定毒性。 |
| 阳离子聚合物转染 |
阳离子聚合物可以与DNA形成稳定的复合物保护DNA免受核酸酶的降解。 |
日益收到重视,但受到细胞类型的局限,出现转染效率不高和细胞毒性的情况。 |
| 纳米聚合物转染 |
纳米级别的高分子阳离子聚合物可与DNA混合形成纳米复合物。 |
更加高效安全且细胞毒性低,更有独特的荧光示踪功能,各个公司已推出商品化产品,能否使用各种难转染细胞还有特验证。 |
| 病毒感染 |
以病毒作为载体,通过病毒感染的方式将外源DNA导入到细胞中的生物学方法。 |
可用于难转染的细胞、原代细胞,体内动物实验等,常用慢病毒感染宿主细胞后将外源基因整合到染色体中构建稳转株。需要根据细胞类型选择合适的病毒类型,病毒载体的构建及包装过程需要1-2个月的周期和一定的人力物力。 |
| 电穿孔法 |
高脉冲电压破坏细胞膜电位,DNA通过膜上形成的小孔导入细胞。 |
需要仪器设备,且对细胞的损伤较大,DNA和细胞用量大,需根据不同细胞类型优化电穿孔实验条件。 |
| 磷酸钙法 |
磷酸钙与DNA复合物吸附细胞膜从而被细胞内吞。 |
可对易转染细胞如293T细胞达到较高的转染效率,但非常不稳定,重复性差,受实验条件的影响很大。 |
| 显微注射法 |
用显微操作技术将DNA直接注入靶细胞核。 |
转染率较高,多用于工程改造或转基因动物的胚胎细胞。需要昂贵的仪器,在导入DNA时需要进行单个细胞地注射,不适合大量细胞研究的需要。 |
Q:如何选择构建稳转株还是瞬时转染/感染?
A:根据外源基因能否整合宿主基因组DNA,可分为稳定转染和瞬时转染。如果需要观察外源基因表达后较短时间内就能检测的功能,可以使用瞬时转染,即在转染后24至96小时内收获细胞;如果想长期观察外源基因表达对于细胞功能的影响则需要构建稳转株。稳定转染需要进行细胞的筛选工作,与瞬时转染相比时间长、工作量大,请根据实验需求选择合适的转染方式。
Q:为什么推荐采用慢病毒感染而不是质粒转染的方式构建稳转株?
| 导入方式 |
导入靶细胞效率 |
整合位点 |
| 慢病毒感染 |
具备宿主范围广、感染效率高的特点 |
外源基因阅读框可完整高效的整合至宿主基因组的转录活跃区域,有利于外源基因的高效转录与表达 |
| 质粒转染 |
对于难转染细胞转染效率较低会导致整合几率极低,故稳定细胞株构建耗时耗力,阳性率很低 |
整合位点随机,且不能保证完整的阅读框架整合至宿主基因组中 |
Q:如何确认靶细胞可以进行慢病毒介导的稳转株构建?
A:首先对细胞进行慢病毒感染的MOI值摸索实验,即确认慢病毒与细胞感染的合适比例,以进行后续稳转株构建。将靶细胞接种至96孔板中,我们设定6-8个不同梯度的慢病毒MOI值感染靶细胞(进行加和不加polybrene的检测),并取易感染的293细胞作为阳性对照。荧光显微镜下观察靶细胞EGFP荧光率,拍照记录各组MOI值下感染效率,确定感染效率达到80%以上的最佳MOI值。
Q:过表达稳定细胞株构建好之后,会出现qPCR及WB检测目的基因没有过表达的情况吗?
A:我们会首先进行目的基因瞬时感染靶细胞后的qPCR和WB检测,没有问题再进行过表达稳定细胞株的药物筛选工作。如果担心抗体质量的问题没有检测到过表达建议客户可以在靶蛋白上融合蛋白标签。稳转株构建经药物筛选完成后如果aPCR和WB检测没有过表达,是不允许交货到客户手中的,即我们确保上海锐赛提供的稳定细胞株经过aPCR和WB确切验证有明显的外源基因表达。
Q:稳定细胞株靶蛋白经qPCR和WB检测有过表达,但是相关功能未能得到阳性结果?
A:首先我们确保载体中靶蛋白对应的核苷酸序列经测序验证序列正确,且阅读框正确无误,与标签蛋白融合无误,并且通过qPCR和WB的验证,另外外源基因在哺乳动物细胞表达中一般都可以进行正确的转录翻译,且翻译后的蛋白能够进行复杂的蛋白折叠和修饰,接近天然蛋白的结构。以上前提条件正确建立后,若蛋白本身未能获得预期的功能,需要确认功能实验的方法,比如是否设定阳性对照,实验方案设计是否合理等,并且多查找相关文献确认是否是有其他因素导致功能实验未获得阳性结果。
Q:收到的稳定细胞株,能够维持多久?
A:客户获得的稳转株一般需在药物筛选浓度值的-半进行维持培养,一般可进行10代以内的检测工作,建议客户尽快进行相应的功能检测实验,不要反复冻存复苏。如果长期培养不慎污染,或细胞状态变差都会影响外源基因的表达。
Q:为什么同一种细胞的阴性对照稳转株构建过程要快于目的基因的稳转株构建过程?
A:外源蛋白的过量或内源蛋白的过低表达往往会影响到宿主细胞的生长状态,因此往往阴性对照细胞的构建过程要快于外源基因的过表达或内源基因的RNAi稳转株。
Q:单克隆稳转株与混合稳转株有何区别?
A:单克隆稳转株是含有稳定整合外源片段的单个细胞的扩增,而混合稳转株则是由多个单克隆稳转核构成的克隆群,不同的单克隆其外源片段的整合位点不一样,表达效率也不同。由于体外细胞多属于病胞系,其基因组呈现不确定的特点,因此即使是同类细胞,不同细胞个体基因组背景都存在差异。当需要去除细胞群体干扰因素的时候,推荐使用单克隆稳定细胞株,其基因组背景相对单一,对实验结果干扰因素小。当进行系统生物学研究时,多考虑这类因素。同时也是由于不同细胞个体差异大,而且不同整合位点的单克隆细胞株表现出来的细胞行为可能不一致,所以许多实验使用混合克隆株更能去除细胞间差异造成的干扰。
参考文献
1.R.Ian Freshney. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications[M].Wiley-Blackwell Press,2011.
2.David L.Spector,Robert D.Goldman, Leslie A. Leinwand.Cells:a Laboratory manual[M].Cold Spring Harbor Labrotary Press,1998.