产品详情
文献和实验
相关推荐
保存条件 :4℃保存
保质期 :有效期2年
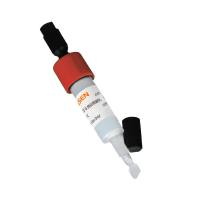
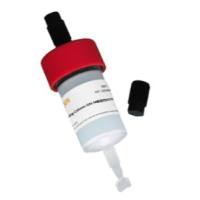
英文名 :HisSep Ni-NTA 6FF Chromatography Column,1ML
库存 :大量
供应商 :翌圣生物科技(上海)股份有限公司
CAS号 :点击查看
规格 :1ml
产品描述
HisSep Ni-NTA Agarose Resin 6FF以高度交联的6%琼脂糖凝胶为基质,通过化学方法偶联四配位的氮川三乙酸(NTA)为配体,螯合镍离子(Ni2+)后,形成非常稳定的八面体结构,镍离子处于八面体的中心,这样的结构可保护镍离子免受小分子的进攻,更加稳定,可以耐受一定浓度的还原剂、变性剂或耦合剂等苛刻条件。此外,因其基质的耐压性(该基质可以耐受最高0.3 MPa的压力),该产品可以用于工业大规模蛋白的纯化,可在相对较高的流速下,实现对目的蛋白的纯化。
HisSep Ni-NTA 6FF Chromatography Column是一种以HisSep Ni-NTA Agarose Resin 6FF为填料的中压预装柱,该预装柱具有标准接口,可以适配商品化的各类中压色谱系统,如ÄKTA等,方便客户用于纯化His-tag蛋白。
产品性质

| 基质(Matrix) |
高度交联的6%琼脂糖凝胶 |
| 粒径(Bead size) |
45-165 µm |
| 载量(Capacity) |
>40 mg 6×His-tagged protein/mL 基质 |
| 耐压(Tolerance Pressuremax) |
0.3 Mpa,3 bar |
| 储存缓冲液(Buffer) |
含20%乙醇的1×PBS |
| 柱子尺寸(Column Size) |
0.7×2.5 cm(1mL) |
运输和保存方法
冰袋运输。4℃保存。有效期2年。
注意事项
1)建议纯化所用缓冲液和蛋白溶液经0.22 µm或0.45 µm滤膜过滤后上柱使用。
2)为了您的安全和健康,请穿实验服并戴一次性手套操作。
3)本产品仅作科研用途!
使用方法
(一)纯化流程
1. 缓冲液的准备
缓冲液使用原理:低咪唑上样,高咪唑洗脱,或者高pH上样,低pH洗脱。Buffer 在使用前最好用0.22 µm或0.45 µm滤膜过滤除菌。可溶性组氨酸标签蛋白纯化所需配方详见附表1。包涵体组氨酸标签蛋白纯化所需缓冲液及配方详见附表2。
2. 样品准备
2.1 细菌表达的蛋白(本说明以细菌表达蛋白为例)
1)挑取单菌落到含有适合抗性的LB培养基中,根据载体说明加入相应的诱导剂诱导相应的时间。
2)表达结束后,将培养液转至离心瓶,7000 rpm,离心15 min,收集菌体,然后加入1/10体积的裂解液(Lysis buffer)和PMSF(PMSF在破碎前加入,其终浓度为1 mM),同时也可加入其他蛋白酶抑制剂,但不能影响目的蛋白与树脂的结合。
3)之后加入溶菌酶,使其工作浓度为1 mg/mL。
注:如果表达的宿主细胞内含pLysS或pLysE,可以不加入溶菌酶。
4)将菌体沉淀悬浮起来(如果菌液浓度高,可考虑加入10 µg/mL RNase A和5 µg/mL DNase I),混匀,置于冰上超声破碎细胞,至菌液基本保持澄清。
5)收集上述澄清蛋白液,10000 rpm,4℃离心20-30 min。取上清,0.22 µm/0.45 µm滤膜过滤后,置于冰上备用或-20℃保存。
2.2 酵母、昆虫和哺乳细胞分泌表达的可溶性蛋白
将细胞培养液转移至离心瓶,5000 rpm离心10 min,收集上清。如上清中不含EDTA、组氨酸和还原剂等,即可直接上柱纯化;如含有EDTA、组氨酸和还原剂等物质,则需用1×PBS 4℃下透析后方可上柱。
注:对于大量体积的上清,需加入硫酸铵进行沉淀浓缩,之后经1×PBS 4℃下透析后上柱。
2.3 包涵体蛋白纯化(以细菌为例)
1)将培养液转移至离心瓶,7000 rpm,离心15 min,收集菌体去上清。
2)按照菌体:裂解液=1:10(w/v)的比例将菌体充分悬浮,混匀,冰浴超声破碎。
3)将破碎液转移至离心管,10000 rpm,4℃离心20-30 min,去上清。可重复步骤2)和3)一次。
4)按照菌体:裂解液(含8 M尿素)=1:10(w/v)的比例将包涵体充分悬浮。
5)变性条件下纯化His标签蛋白纯化。
3. 样品纯化(以AKTA使用为例)
1)将泵管道注满去离子水。去掉产品上塞,连接至色谱系统中,再折断下口,将预装柱连接到色谱系统中,注意旋紧。
2)3-5倍柱体积去离子水冲洗出存储缓冲液。
3)至少5倍柱体积的Lysis Buffer 平衡色谱柱。推荐流速为1 mL/min。
4)利用泵或注射器上样。
注:若样品粘度增加,即使上样体积很少也会导致层析柱很大的反压;上样量不要超过柱子的结合能力;大量的样品体积也可能造成很大的反压,使得进样器更难使用。
5)Wash Buffer 平衡柱子,直到紫外吸收达到一个稳定的基线(一般至少10-15个柱体积)。
注:在样品和结合缓冲液中加入低浓度咪唑可以提高样品纯度。
6)Elution Buffer一步法或梯度法进行洗脱。一步法洗脱中一般5倍柱体积洗脱液即可。梯度洗脱可以用一个小的梯度,例如20倍柱体积或更多来分离不同结合强度的蛋白质。
7)建议用更高浓度咪唑(如500 mM)彻底清洗纯化柱上结合的杂蛋白。随后依次用3倍柱体积的Lysis Buffer和5倍柱体积的去离子水清洗树脂。5倍柱体积的20%乙醇平衡树脂,置于4℃保存。
4. SDS-PAGE检测
将纯化过程中得到的样品(包括原始样品、流出组分、洗杂及洗脱组分等)利用SDS-PAGE进行检测,判定其纯化效果。
(二)在位清洗
当填料使用过程中发现反压过高(>0.5 Mpa)或者填料上面出现明显的污染时,需对其进行在位清洗(Cleaning-in-Place,CIP)。在位清洗时,先把Ni2+脱掉,清洗结束后,将填料保存在20%乙醇中,后者重新挂Ni后再保存在20%乙醇中。建议按照下面操作去除填料上残留的污染物,如沉淀蛋白、疏水蛋白和脂蛋白等。
1 去除强疏水结合的蛋白,脂蛋白和脂类
使用30%异丙醇清洗5-10个柱体积,接触时间为15-20 min可以去除此类污染物。之后再用去离子水清洗10倍柱体积。也可以选择使用含有去污剂的酸性或者碱性溶液清洗填料2倍柱体积。例如含有0.1-0.5%非离子去污剂的0.1 M醋-酸溶液,接触时间为1-2 h。去污剂处理后,需用70%的乙醇清洗5倍柱体积,彻底去除去污剂。最后利用去离子水清洗10倍柱体积。
2 去除离子作用结合的蛋白
使用1.5 M NaCl 溶液接触10-15 min,之后用去离子水清洗10倍柱体积。
(三)填料再生
当填料使用过程中发现反压过高(>0.5 Mpa),填料上面出现明显的污染,或填料载量明显变低时,需要对其进行镍离子剥离及重新挂镍处理,即填料再生。按照下面操作流程进行:
1)使用5倍柱体积去离子水清洗填料;
2)使用5倍柱体积100mM EDTA(pH 8.0)剥落镍离子;
3)使用10倍柱体积去离子水清洗填料;
4)使用0.5M NaOH清洗5倍柱体积,停留10-15min;
5)使用10倍柱体积去离子水清洗填料;
6)使用3-5倍柱体积100mM NiSO4再生挂镍;
7)去离子水清洗10倍柱体积。
填料再生后,可立即使用,也可保存在20%乙醇中,置于4℃备用。
附表1 可溶性His标签蛋白纯化所需缓冲液及配方
| 缓冲液名称 |
配方 |
配制1L溶液所需各种试剂量 |
| Lysis Buffer (pH8.0) |
50 mM NaH2PO4 300 mM NaCl 10 mM imidazole NaOH调pH至8.0,0.22 µm或0.45 µm过滤除菌 |
NaH2PO4 ·2H2O 7.8 g NaCl 17.54 g Imidazole 0.68 g |
| Wash Buffer (pH8.0) |
50 mM NaH2PO4 300 mM NaCl 20 mM imidazole NaOH调pH至8.0,0.22 µm或0.45 µm过滤除菌 |
NaH2PO4 ·2H2O 7.8 g NaCl 17.54 g Imidazole 1.36 g |
| Elution Buffer(pH8.0) |
50 mM NaH2PO4 300 mM NaCl 250 mM imidazole NaOH调pH至8.0,0.22 µm或0.45 µm过滤除菌 |
NaH2PO4 ·2H2O 7.8 g NaCl 17.54 g Imidazole 17.0 g |
附表2 包涵体His标签蛋白纯化所需缓冲液及配方
| 缓冲液名称 |
配方 |
配制1L溶液所需各种试剂量 |
| Lysis Buffer,pH8.0 |
8 M Urea 100 mM NaH2PO4 100 mM Tris·HCl 盐酸溶液调pH至8.0,0.22 µm或0.45 µm过滤除菌 |
Urea 480.5 g NaH2PO4 ·2H2O 15.6 g Tris 15.76 g |
| Wash Buffer,pH6.3 |
8 M Urea 100 mM NaH2PO4 100 mM Tris·HCl 盐酸溶液调pH至6.3,0.22 µm或0.45 µm过滤除菌 |
Urea 480.5 g NaH2PO4 ·2H2O 15.6 g Tris 15.76 g |
| Elution Buffer,pH4.5 |
8 M Urea 100 mM NaH2PO4 100 mM Tris·HCl 盐酸溶液调pH至4.5,0.22 µm或0.45 µm过滤除菌 |
Urea 480.5 g NaH2PO4 ·2H2O 15.6 g Tris 15.76 g |
附表3 HisSep Ni-NTA Agarose Resin 6FF试剂耐受情况
| 试剂种类 |
浓度 |
| 还原剂 |
5 mM DTE 0.5-1 mM DTT 20 mM β-mercaptoethanol 5 mM TCEP 10 mM reduced glutathione |
| 变性剂 |
8 M urea 6 M Gua-HCl |
| 去污剂 |
2% TritonTM X-100(nonionic) 2% TweenTM20(nonionic) 2% NP-40(nonionic) 2% Cholate (anionic) 1% CHAPS (zwitterionic) |
| 其他类 |
500 mM imidazole 20% ethanol 50% glycerol 100 mM Na2SO4 1.5 M NaCl 1 mM EDTA 60 mM citrate |
| 缓冲液 |
50 mM sodium phosphate,pH 7.4 100 mM Tris-HCl,pH 7.4 100 mM Tris-acetate,pH 7.4 100 mM HEPES,pH 7.4 100 mM MOPS,pH 7.4 100 mM sodium acetate,pH 7.4 |
附表4 问题及解决方案
| 问题 |
可能原因 |
推荐解决方案 |
| 柱子反压过高 |
填料被堵塞 |
裂解液中可能含微小的固体颗粒,建议上柱前使用滤膜(0.22 µm或0.45 µm)过滤,或离心去除。 |
| 样品中含高浓度的核酸,延长破碎时间直至粘度降低,或添加DNaseI (终浓度为5 µg/mL),Mg2+(终浓度1 mM),冰上孵育10-15 min |
||
| 样品太黏稠 |
有机试剂或蛋白稳定试剂(如甘油等)可能会引起反压增高,降低操作流速。 |
|
| 洗脱组分中无目的蛋白 |
蛋白可能是包涵体 |
可通过电泳检测裂解液,分析上清中是否有目的蛋白,包涵体蛋白需按照包涵体蛋白的纯化方式 |
| 表达量太低 |
优化表达条件,使用包涵体纯化缓冲体系 |
|
| 目的蛋白结合比较弱,在洗杂步骤中已被洗下来 |
提高Wash Buffer的pH值,或者降低咪唑浓度 |
|
| 目的蛋白结合过强,不容易洗脱下来 |
降低Elution Buffer的pH,或者增加Elution Buffer中的咪唑浓度 |
|
| 使用10-100 mM EDTA溶液剥离镍离子,同时得到蛋白 |
||
| 蛋白降解 |
菌体破碎时需添加一些蛋白酶抑制剂 |
|
| 在4℃下进行纯化操作 |
||
| 洗脱组分不纯(含多种蛋白) |
洗杂不彻底 |
增加Wash Buffer 体积 |
| 样品中含有其他His标签蛋白 |
通过调节pH值或咪唑浓度来优化洗杂条件。再使用其他纯化手段(如去离子交换,疏水等)进一步纯化洗脱组分。 |
|
| 填料颜色变浅或变成白色 |
镍离子脱落或者剥离 |
按照填料再生的操作重新挂镍离子 |
| 填料呈现褐色 |
缓冲液中含有DTT等还原剂 |
参考附3适当降低还原剂DTT的浓度,或改用巯基乙醇 |
| 上样过程中蛋白发生沉淀 |
操作温度太低 |
室温下进行上样 |
| 蛋白发生聚集 |
在样品和所有缓冲液中添加稳定剂,如0.1%Triton X-100或Tween-20 |
相关产品
| 20502ES10 |
10 mL |
|
| 20502ES50 |
50 mL |
|
| 20502ES60 |
100 mL |
|
| 20502ES80 |
1000 mL |
|
| 20503ES10 |
10 mL |
|
| 20503ES50 |
50 mL |
|
| 20503ES60 |
100 mL |
|
| 20504ES08 |
HisSep Ni-NTA 6FF Chromatography Column, 5 mL(His标签蛋白纯化预装柱,5 mL) |
5 mL |
| 20504ES25 |
HisSep Ni-NTA 6FF Chromatography Column, 5 mL(His标签蛋白纯化预装柱,5 mL) |
5×5 mL |
HB 180820

翌圣生物科技(上海)股份有限公司
品牌商实名认证
钻石会员
入驻年限:17年