产品详情
文献和实验
相关推荐
库存 :999
英文名 :Animal DNA Extraction Kit
保质期 :一年有效
供应商 :百瑞极
保存条件 :常温(10~25℃)保存 12 个月,其中 Proteinase K 保存条件 -20℃。
规格 :50T
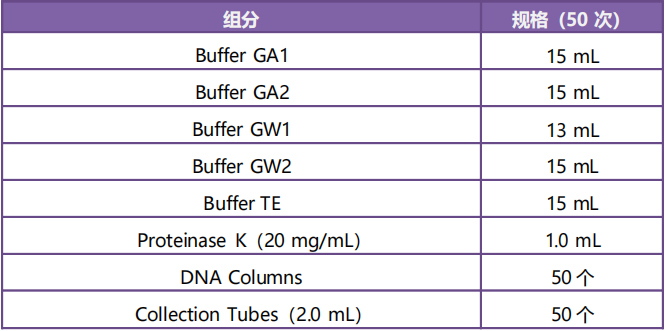
产品组成
保存条件
常温(10~25℃)保存 12 个月,其中 Proteinase K 保存条件 -20℃。
产品简介
本试剂盒可从≤25 mg 新鲜或冷冻的动物组织(比如鼠尾、鼠趾、肝脏等)、血液、细胞中快速提取基 因组 DNA。 试剂盒采用优化的缓冲体系,使裂解液中的DNA高效特异地结合到硅基质吸附柱上。提 取过程无需使用苯酚或氯仿等有毒溶剂,得到的 DNA 浓度和纯度高,可直接用于酶切、PCR、文库构建、 Southern Blot、分子标记等下游实验。
产品特点
⚫ DNA质量高:提取的DNA浓度和纯度较高,适用于对浓度、纯度和完整性要求较高的下游实验;
⚫ 安全低毒:无需酚、氯仿等有毒试剂。
适用范围
本品适用于冷冻或新鲜动物组织样本、新鲜血液、细胞样本的基因组DNA提取。
注意事项
1. 第一次使用前,按瓶上标签要求在 Buffer GW1 和 Buffer GW2 中加入相应体积的无水乙醇;
2. 使用前请检查 Buffer GA1 和 Buffer GA2 是否出现沉淀,如有请于 37˚C 水浴溶解后使用;
3. 若下游实验受 RNA 影响较大,可在步骤 2 结束后按照要求加入 RNase A(目录号: BN20386);
4. 为保证基因组 DNA 得率及完整性,样品请勿反复冻融;
5. 所有离心操作均在室温下进行。
使用方法
1. 样本处理
1) 血液及细胞样本:
a. 哺乳动物抗凝血液(无核红细胞):直接向 50~200 μL 新鲜或冷冻的抗凝血液样品中加入 Buffer GA1 补足至 200 μL;
b. 禽类,鸟类,两栖类或更低级生物的抗凝血液:其红细胞为有核细胞,取 5~20 μL 新鲜或冷冻的 抗凝血液样品,加入 Buffer GA1 补足至 200 μL;
c. 贴壁培养的细胞:应先处理为细胞悬液(最大提取量为 5×106个细胞),10,000 rpm(~11,200× g)离心 1 min,弃尽上清,加 200 μL Buffer GA1,振荡至样品彻底悬浮;
注意:如需去除 RNA,可在上述步骤完成后,加入 4 μL 浓度为 100 mg/mL 的 RNase A 溶液(目录号: BN20386),涡旋 15 s,室温放置 5 min。
2. 加入 20 μL Proteinase K 溶液,混匀后加入 200 μL Buffer GA2,涡旋振荡充分混匀,70˚C 水 浴 10 min;
3. 短暂离心以去除管盖内壁的水珠。加入 200 μL 无水乙醇,涡旋振荡充分混匀,短暂离心,进入 步骤 4 过柱纯化;
2)动物组织样本:
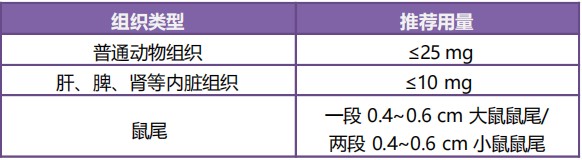
1. 样本处理:正确的组织取样量是获得理想产量和纯度的关键。初次使用时,推荐动物组织量为 10~15 mg, 根据实验过程及结果再调整用量。样品可用液氮研磨,或机械/玻璃匀浆器等工具进行匀浆。
a. 针对普通动物组织、内脏组织等易于研磨的样本:
液氮研磨:将研磨后的样品置于 1.5 mL 离心管中,加入 200 μL Buffer GA1;
匀浆器匀浆:匀浆前向样本中加入≤80 μL Buffer GA1 进行匀浆,匀浆后再加入120 μL Buffer GA1;
b. 针对鼠尾等含较硬组织的样本(过夜消化 6~8 h):将组织样品直接置于 1.5 mL 离心管中,加入 200 μL Buffer GA1;
注意:确保各组织的量不超出推荐范围。样品量过多可能导致裂解不充分,导致裂解液粘稠堵塞吸附柱, 可能造成提取失败或得率低。
2. 加入 20 μL Proteinase K (20 mg/mL),涡旋振荡彻底混匀。普通动物组织 56˚C 水浴充分裂解 1~3 h(鼠尾等较硬样本需过夜消化 6~8 h),期间可数次颠倒或振荡使样品分散。如需去除 RNA, 可在此步骤完成后,加 入 4 μL 浓度为 100 mg/mL 的 RNase A 溶液(目录号:BN20386),涡 旋振荡 15 s,室温放置 5~10 min;
注意:若涡旋振荡或孵育后仍有胶状物,可再次加入 20 μL Proteinase K 后孵育或延长孵育时间。
3. 加入 200 μL Buffer GA2,涡旋振荡充分混匀,70˚C 水浴 10 min。短暂离心后加入 200 μL 无水乙 醇, 立即涡旋振荡充分混匀(此步骤可能会产生白色沉淀,不影响后续实验,某些组织如脾、肺,可 能形成溶胶状产物,此时推荐进行剧烈振荡或涡旋处理),进入步骤 4 过柱纯化;
过柱纯化:
4. 短暂离心,将步骤 3 所得溶液和絮状沉淀全部加入吸附柱中(吸附柱放入收集管中),12,000 rpm(~13,400 ×g)离心 30 s,倒掉收集管中废液,将吸附柱重新放回收集管中,若一次不能加 完溶液,可分多次转入;
5. 向吸附柱中加入500 μL Buffer GW1(使用前检查是否已加入无水乙醇),12,000 rpm(~13,400 ×g)离心 30 s,倒掉收集管中废液,将吸附柱重新放回收集管中;
6. 向吸附柱中加入600 μL Buffer GW2(使用前检查是否已加入无水乙醇),12,000 rpm(~13,400 ×g)离心 30 s,倒掉收集管中废液,将吸附柱重新放回收集管中;
7. 重复步骤 6 ; 8. 12,000 rpm(~13,400×g)离心 2 min,开盖室温晾干数分钟;
注意:此步为去除残余漂洗液,不可省略。
9. 将吸附柱置于新的离心管(自备)中, 向吸附膜中间部位悬空滴加 50~200 μL Buffer TE 或 ddH2O,室温放置 2~5 min,12,000 rpm(~13,400 ×g)离心 2 min,收集 DNA 溶液,-20℃ 保存 DNA。
注意:
1) 若需增加产量,可将得到的溶液重新加入到吸附柱中,室温放置 2~5 min,12,000 rpm(~13,400×g) 离心 2 min;
2) 如果下游实验对 pH 值或 EDTA 敏感,可以用灭菌水洗脱。洗脱液的 pH 值对洗脱效率有较大影响, 若用水作洗脱液应保证其 pH 值在 7.0~8.5(可以用 NaOH 将水的 pH 值调到此范围),如需长期保存,推荐用 Buffer TE 洗脱并于 -20°C 保存。
常见问题与解决办法
Q1:柱子堵塞?
A1:
1) 样品用量过多。建议按照说明书推荐量进行提取,尤其是富含 DNA 的组织需注意减少用量;
2) 样品未充分裂解或研磨。充分裂解或研磨样品,鼠尾组织建议过夜消化;
3) 离心温度过低。本产品使用操作均在室温下进行。 Q2:DNA 得率低?
A2:
1) 样品裂解不充分。若样品过量则适当减少样品量,延长56˚C孵育时间,或在步骤 2 中再加入 20 μL Proteinase K(20 mg/mL)消化;
2) 样品用量过少。建议按照说明书推荐量进行提取;
3) 样品材料质量不好。尽量选用新鲜组织样品,样品采集后应液氮速冻,然后置于-80℃保存,建议尽快提取,避免反复冻融。
Q3:后期实验受 RNA 影响?
A3:
1) 未加入 RNase A 消化。若后续实验需要去除 RNA 影响, 可按照说明书步骤加入 RNase A 消化;
2) 样品中RNA含量过多。可适当增加 RNase A 用量或延长消化时间。

北京百瑞极生物科技有限公司
实名认证
金牌会员
入驻年限:5年