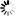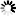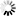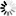
产品详情
文献和实验
相关推荐
品系 :N/A
ATCC Number :N/A
细胞类型 :N/A
肿瘤类型 :N/A
CAS号 :N/A
供应商 :上海曼博生物医药科技有限公司
库存 :1000
注册证号 :N/A
英文名 :Human AB Serum
生长状态 :N/A
年限 :5年
运输方式 :-20℃
器官来源 :N/A
是否是肿瘤细胞 :N/A
细胞形态 :N/A
免疫类型 :N/A
物种来源 :N/A
相关疾病 :N/A
组织来源 :N/A
规格 :100mL
产品描述:美国AKRON公司产品人AB血清,原材料为Octaplas的富集人源血浆,具备无动物源以及病毒灭活等特点,是按照相关的cGMP辅助材料指南制造、测试和放行,并且专为细胞和基因治疗应用而制备。通过利用Octaplas—一种制药许可级别的病毒灭活以及朊病毒配体处理的血浆为原材料,AKRON目前提供高质量的病毒灭活的人AB血清产品,具有较高的批间一致性和安全性。
产品优势:
供体筛查
• 按照《美国联邦法规》21 CFR 610.40要求进行病原体筛查测试,并发现相关测试呈阴性或无反应。
血浆来源
• 采用Octaplas 经 FDA批准, 灭菌, 无热原的, 冷冻, S/D处理, 朊病毒配体, 富集的人源血浆;
• 采用S/D方法处理灭活包膜病毒
• 采用免疫中和方法处理使某些非包膜病毒失活
• 采用亲和层析法减少朊病毒蛋白
• 采用无菌过滤最大限度地减少细菌和寄生虫的存在
生产
• 该产品的制造中使用了人类来源的材料,减少了遗传或免疫不相容风险。
• 无菌过滤后无菌灌装
质量
• 按照相关cGMP 法规进行生产,测试,和放行。
• 符合USP <1043>章则,细胞、基因和组织工程产品辅助材料
• 符合ISO 13485:2016,医疗器械—质量管理体系—法规要求
• 符合ISO/TS 20399-1-3:2018,生物技术—细胞治疗产品生产过程中的辅助材料
• 支原体,内毒素和无菌测试
放行测试:
• 外观
• pH
• 渗透压
• 总蛋白
• 支原体
• 细菌内毒素
• 无菌
• 代谢 & 脂质组
稳定性:
• -20℃存储
• 干冰运输
• 避免反复冻融循环
病毒安全验证
· 采用S/D方法处理灭活包膜病毒
· 采用标准化的中和抗体处理某些非包膜病毒
· 病毒灭活的验证性研究
病原体安全性
· 无菌过滤后无菌灌装
· 内毒素 (USP <85> / EP 2.6.14), 无菌 (USP <71> / EP 2.6.1), 以及支原体 (USP <63>)
一致性
· FDA批准, 无菌, 无热原, 冷冻,S/D处理, 富集来自美国捐赠者的AB血浆作为原料
· 富集血浆减少供体群体的异质性
· 按照相关cGMP指南的ISO 13485标准生产

使用声明:
用于研究或进一步制造用于体外细胞治疗应用。本产品不支持直接在体内使用,也不支持作为药 物、治疗、生物或医疗器械直接临床使用。
规格货号:
规格:瓶装 (100 mL) ;货号: Cat. # AR1010-0100
进口流程:
1. 询价(客户)
2. 报价(我司)
3. 确定采购和签订合同(客户和我司)
4. 收集产品审批信息(我司)
5. 进行风险评估,获得入境特殊物品审批单(客户自行办理,或客户委托我司代办,代办需要客户需提供CIQ账号以及密码)
6. 通知国外发货(我司)
7. 国际运输和国内口岸清关(我司)
8. 国内运输送达客户指定地点(我司)
9. 通知海关进行后续监管(客户)
更多详情咨询:
上海曼博生物医药科技有限公司
MineBio Life Sciences Ltd.
www.mine-bio.com

上海曼博生物医药科技有限公司
代理商实名认证
钻石会员
入驻年限:6年