产品详情
文献和实验
相关推荐
保存条件 :零下20度
保质期 :三年
英文名 :pFLD1 Z+序列pFLD1 Z+图谱/pFLD1 Z+质粒pFLD1 Z+载体
库存 :支
供应商 :继和生物
CAS号 :无
pFLD1 Z+序列pFLD1 Z+图谱/pFLD1 Z+质粒pFLD1 Z+载体质粒DNA的提取质粒DNA的提取,由于其本身分子量小,一般采用碱裂解法提取。目前已研发出多种质粒提取试剂盒,实验操作简单,只需按照产品操作说明操作即可。不过对于其中主要试剂和作用的理解,能够避免实验过程中的一些问题,或者能够更好的解决问题。
各厂家提供的试剂盒中试剂不尽相同,一般的提取纯化试剂盒,主要包括以下试剂:

A. 细胞悬浮试剂: 主要作用是将菌体细胞悬浮起来。菌体悬浮不完全会导致裂解不完全,质粒的提取纯度和得率都会下降。通常需要在里面加入RNA酶(RNase A),RNA酶的作用很清楚,降解掉溶液中的RNA。通常选用Tris-HCl作为体系中pH稳定缓冲液。EDTA,金属离子螯合剂可以和细菌体内的金属离子结合而DNase的活性受到抑制。有的会有葡萄糖,可用来增加溶液粘度,保证菌体悬浮,延缓菌体沉淀时间。
B. 细胞裂解试剂:主要作用是裂解细胞,通过碱溶液的作用破坏细胞膜结构,使其双层膜结构改变,而导致细胞裂解。一般由一定浓度的NaOH和SDS组成。SDS的作用与后期中和过程中清除掉蛋白质等细胞杂质有关系。此步骤中需要注意的是,碱溶液的作用时间不能太长,也不可剧烈离心管,反之会导致碱破坏基因组DNA,导致同等大小的基因组DNA被提纯,造成污染。
C. 中和试剂:主要作用使中和掉细胞裂解试剂中的碱性物质,并去除掉其中的蛋白等杂质物质。组份有醋酸钾和醋酸,或者乙酸钾和冰乙酸。
D. 清洗Buffer: 主要是清洗掉多余的盐离子。DNA被试剂盒中的提取柱吸附之后,需要用wash buffer 洗脱掉多余的盐离子。主要成分有Tris-HCl和乙醇。需要注意的使乙醇对后续酶切和测序反应会有影响,因此在后续洗脱DNA前,必须完全清除柱子中的乙醇。
E. 洗脱Buffer: 主要作用就是洗脱硅胶柱上的DNA样品。
1.柱平衡:在柱中加入2ml的平衡buffer,通过重力的作用,使平衡buffer都流出。
2.细胞收获:对于高拷贝质粒(培养液中,>2µg DNA/mL),吸取1-3ml培养液,离心去上清;对于低拷贝质粒(培养液中,<2µg DNA/mL),吸取10-15ml培养液,离心去上清。
3. 细胞悬浮:加0.4mL的细胞悬浮液(containing RNase A)悬浮细胞,并使其混匀。
4. 细胞裂解:加入0.4mL细胞裂解液,通过上下颠倒带盖子管子5次使其轻轻混匀,不要涡旋,之后在室温下放置5min.
5. 中和:加入0.4mL的中和试剂,立即混合均匀。当大的细胞颗粒被处理后,可能会进行更剧烈的摇动。但是,不要涡旋!~12,000xg离心混合物10min. 如果是采用的4°离心,上清液需要恢复到室温,再加入到柱子中。
6. 装柱:吸取步骤5中的上清液到平衡柱中。让混合液通过重力的作用流出,弃掉流出液。
7. 柱子清洗:2.5 mL的Wash Buffer洗脱柱子量次。每次清洗让清洗液通过重力的作用流出,弃掉流出液
8. 质粒DNA洗脱:加入0.9mL的Elution Buffer。让Elution Buffer通过重力的作用流出。不要强行弄出里面的液体。
9. 质粒DNA沉淀:加入0.63mL异丙醇去析出,混匀,~12,000xg at/4°C离心30min。小心的去掉上清,之后风干10分钟
10. DNA纯化:将管子中的DNA溶解到TE buffer中。将这些溶液转移到新管中。

pFLD1 Z+序列pFLD1 Z+图谱/pFLD1 Z+质粒pFLD1 Z+载体重组质粒鉴定的方法:
① 双酶切后跑电泳;直接DNA电泳可判断整个DNA重组质粒是否正确。② PCR(插入片段在2kb以下时),然后电泳。
③ 送公司测序(最为准确的鉴定方式)。
影响转化效率的因素:
① 细胞状态和细胞密度: 培养菌最好选用传代次数少,且保存于-70℃或者-20℃。不要使用经过多次转接或者保存于4℃环境中培养菌。细胞生长密度以刚进入对数其为最好,可通过检测培养液的OD600值来判断,密度过高或者不足,都会影响转化效率。通常DH5α菌株在OD600的值为0.5左右,细胞密度在5*107个/ml左右比较合适。密度过高或者不足均会影响转化效率。
② 质粒的质量和浓度:转化的质粒DNA中,超螺旋状态的质粒,转化效率最好。在一定浓度范围内,转化的效率与添加质粒的浓度成正比。不过在添加的质粒的量和体积过大的时候,转化效率也会降低。质粒的分子量越大,通常来说转化率也会降低。
③试剂的质量:转化过程中所用的试剂,如氯化钙的浓度和纯度非常重要,不同批次不同厂家的产品均可影响感受态转化率。
④防止杂菌和DNA污染:实验需要在无菌条件下进行,所用的仪器和试剂均需要灭菌处理,并防止在实验过程中引入其他污染。
⑤培养过程的条件:培养瓶中培养基的量关乎到菌体生长过程中的能量代谢。通常来说厌氧环境做出来的感受态的转化效率较低。建议500ml三角瓶液体培养基量不超过100ml, 250ml三角瓶液体培养基量不超过50ml. 培养基的pH值要适宜,接种前一般pH值在6.8-7.2,等培养结束后可以再测一下pH值最好在6.5以上(不低于6.0),表示菌体的代谢为有氧代谢,生长状态良好。培养基中的各种离子和温度,也对形成好的感受态有关系。
几种扩增常用感受态细胞:
① 普通骨架载体cDNA产品
DH5α:常用于质粒克隆,可用于蓝白斑筛选
TOP10:适用于高效的DNA克隆和质粒扩增,能够保证高拷贝质粒的稳定遗传。
TG1: 生长速度快,常用于噬菌体的制备,同时也可用于普通质粒的构建。
CopyCutter:适用于有毒克隆。
② 慢病毒载体质粒:
Stbl3: 是慢病毒载体系统推荐使用的菌株,可有效抑制长片段末端重复区的重组,降低错误重组的概率
Stable(NEB):可用于逆转录病毒/慢病毒载体系统扩增。
载体构建(vectorconstruction),为把DNA分子运送到受体细胞中去,必须寻找一种能进入细胞、在装载了外来的DNA片段后仍能照样复制的运载体。理想的运载体是质粒(plasmid),在基因工程中,常用人工构建的质粒作为载体。载体构建即是构建含外源DNA的质粒。
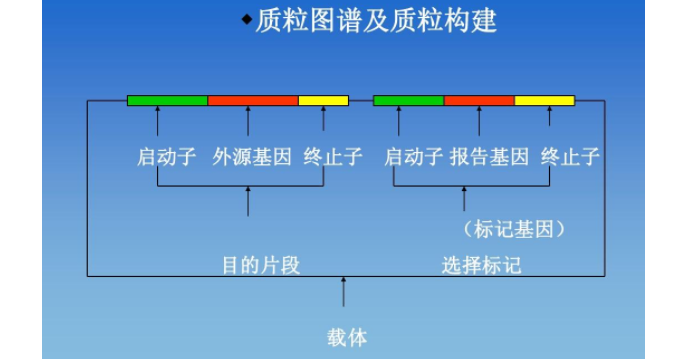
pFLD1 Z+序列pFLD1 Z+图谱/pFLD1 Z+质粒pFLD1 Z+载体载体构建是分子生物学研究常用的手段之一。主要包括已有载体多克隆位点MCS的改造和已有载体启动子、增强子、筛选标记等功能元件的改造。载体构建完成后可利用PCR原理进行测序验证。
人工构建质粒
人工构建的质粒可以集多种有用的特征于一体,如含多种单一酶切位点、抗生素耐药性等。常用的人工质粒运载体有pBR322、pSC101。pBR322含有抗四环素基因(Tcr)和抗氨苄青霉素基因(Apr),并含有5种内切酶的单一切点。如果将DNA片段插入EcoRI切点,不会影响两个抗生素基因的表达。但是如果将DNA片段插入到Hind Ⅲ、BamH Ⅰ 或 SalⅠ切点,就会使抗四环素基因失活。这时,含有DNA插入片段的pBR322将使宿主细菌抗氨苄青霉素,但对四环素敏感。没有DNA插入片段的pBR322会使宿主细菌既抗氨苄青霉素又抗四环素,而没有pBR322质粒的细菌将对氨苄青霉素和四环素都敏感。pSC101与pBR322相似,只是没有抗氨苄青霉素基因和PstI切点。质粒运载体的最大插入片段约为10 kb(kb表示为千碱基对)。
选择质粒载体的要素是要了解可用到的载体的特征和预测重组克隆所用于的实验。
所有的质粒载体都有三个共同的特征:一个复制子、一个选择性标志和一个克隆位点。复制子是含有DNA复制起始位点的一段DNA(ori),也包括表达由质粒编码的复制必需的RNA和蛋白质的基因。选择性标志对于质粒在细胞内持续存在时必不可少的。克隆位点是限制性内切酶切割位点,外源性DNA可由此插入质粒内,而且并不影响质粒的复制能力,或为宿主提供选择性表型。
选择性标志:编码抗生素抗性的基因对质粒载体来说是最普遍的细菌选择性标志(如pBR322);主要的抗生素选择基因有:氨苄青霉素,氯霉素,四环素和卡那霉素四种。转化的宿主菌一般都是抗生素敏感型的,获得质粒后,它能在有抗生素的平板上生长,从而达到筛选的要求。另一个显性的选择标志就是对λ噬菌体感染的免疫(也就是λ阻抑物)。有时也会用的一些隐性标志,如leuB-(亮氨酸存在时就不能生长)。
如今的载体都含有一多克隆位点(Multiple cloning site, MCS)或多位点接头[包含约20个串联排列的限制性内切核酸酶位点(如pUC19)]这些位点在载体内通常是的,这样就可以防止插入片段插入不恰当的位置,如载体其他的特征导致破裂的位点。多克隆位点的存在可以确保载体合适大部分的DNA片段,可以针对插入片段提供特定的酶切位点图谱,在质粒重组操作方面具有更大的灵活性。在选择质粒载体时既要考虑在多接头处出现的是何位点,又要考虑到这个位点的顺序,因为必须确保特定的位点存在于多接头里。

上海继和生物科技有限公司
实名认证
金牌会员
入驻年限:7年