1885 年,一位妇人带着她被恶犬咬伤的孩子来到路易斯・巴斯德实验室的门口,苦苦哀求巴斯德救救她的孩子。巴斯德也因此给这个孩子注射了人类历史上的第一针狂犬病疫苗。此后的一百多年中,狂犬病疫苗取得了巨大的成功,也因此挽救了无数人的生命。
但不幸的是,除了疫苗之外,一百年后的人类并没有其他手段来应对这种发病后死亡率接近 100% 的可怕疾病。 图片来源:Genome Biology
图片来源:Genome Biology
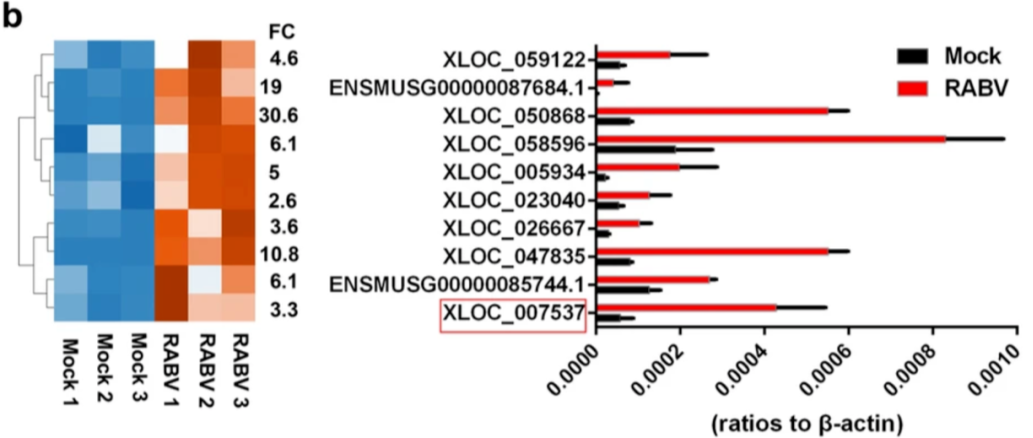 图片来源:Genome Biology 为了探究大脑中 lncRNA 多样性与病毒易感性之间的关系,作者对感染了狂犬病病毒的神经细胞和对照组细胞进行了 RNA-seq,并筛选出 1434 个出现显著变化的 lncRNA。
图片来源:Genome Biology 为了探究大脑中 lncRNA 多样性与病毒易感性之间的关系,作者对感染了狂犬病病毒的神经细胞和对照组细胞进行了 RNA-seq,并筛选出 1434 个出现显著变化的 lncRNA。
通过对其中的 6 个进行克隆过表达,作者发现 XLOC_007537 在多种嗜神经病毒感染后都出现了显著上调,这种上调也仅仅在神经细胞系中出现。这证明 XLOC_007537 是一种病毒诱导的神经特异性 lncRNA。更重要的是,过表达 XLOC_007537 能够有效阻止狂犬病病毒感染神经细胞。由于后续实验表明 XLOC_007537 能够结合 EZH2 并导致后者的降解,所以作者将其命名为 EDAL (EZH2 degradation-associated lncRNA, EDAL)。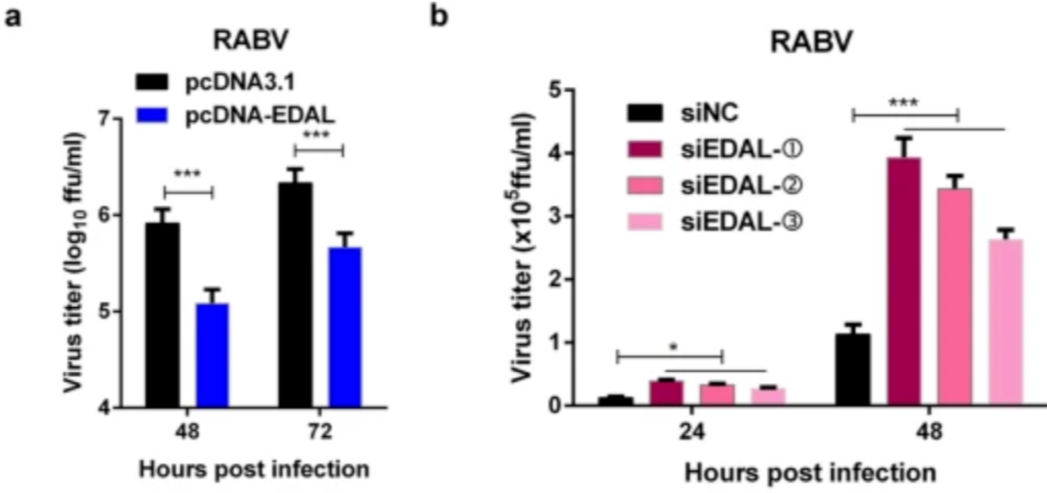 图片来源:Genome Biology 为了进一步验证 EDAL 的功能,作者在 N2a 神经细胞中敲入与敲低了 EDAL,并发现敲入与敲低 EDAL 分别降低与增加了狂犬病病毒滴度。在其他诸如水疱性口炎病毒(VSV)、单纯疱疹病毒 (HSV-1) 与生里基森林病毒(SFV)的嗜神经病毒中,作者也观测到了类似的现象。这些数据证明 EDAL 能有效阻止多种嗜神经病毒的复制。
图片来源:Genome Biology 为了进一步验证 EDAL 的功能,作者在 N2a 神经细胞中敲入与敲低了 EDAL,并发现敲入与敲低 EDAL 分别降低与增加了狂犬病病毒滴度。在其他诸如水疱性口炎病毒(VSV)、单纯疱疹病毒 (HSV-1) 与生里基森林病毒(SFV)的嗜神经病毒中,作者也观测到了类似的现象。这些数据证明 EDAL 能有效阻止多种嗜神经病毒的复制。
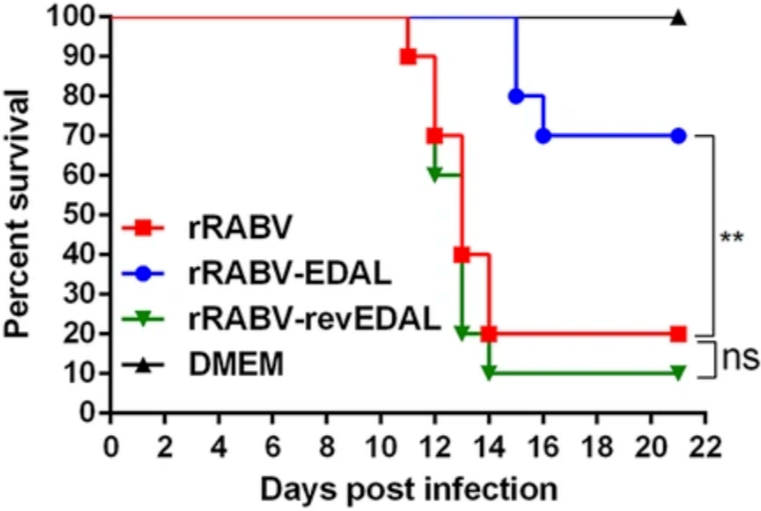 图片来源:Genome Biology 随后,作者对 EDAL 在狂犬病病毒中的作用进行了动物实验验证。感染携带 EDAL 基因的狂犬病病毒后,小鼠的存活率显著高于对照组小鼠,并在体重、临床评分、以及病毒拷贝等多项指标上出现了明显的改善。免疫组化染色也证明多个脑区中的狂犬病病毒 P 蛋白与 CD45+ 细胞数都出现了明显的降低。这些数据进一步佐证了 EDAL 对狂犬病病毒的抑制作用。
图片来源:Genome Biology 随后,作者对 EDAL 在狂犬病病毒中的作用进行了动物实验验证。感染携带 EDAL 基因的狂犬病病毒后,小鼠的存活率显著高于对照组小鼠,并在体重、临床评分、以及病毒拷贝等多项指标上出现了明显的改善。免疫组化染色也证明多个脑区中的狂犬病病毒 P 蛋白与 CD45+ 细胞数都出现了明显的降低。这些数据进一步佐证了 EDAL 对狂犬病病毒的抑制作用。
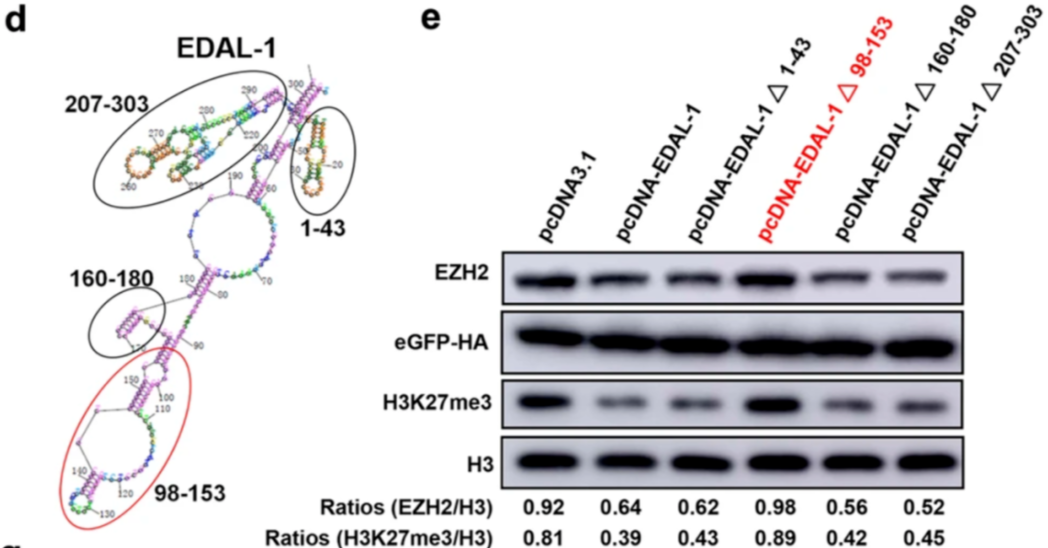
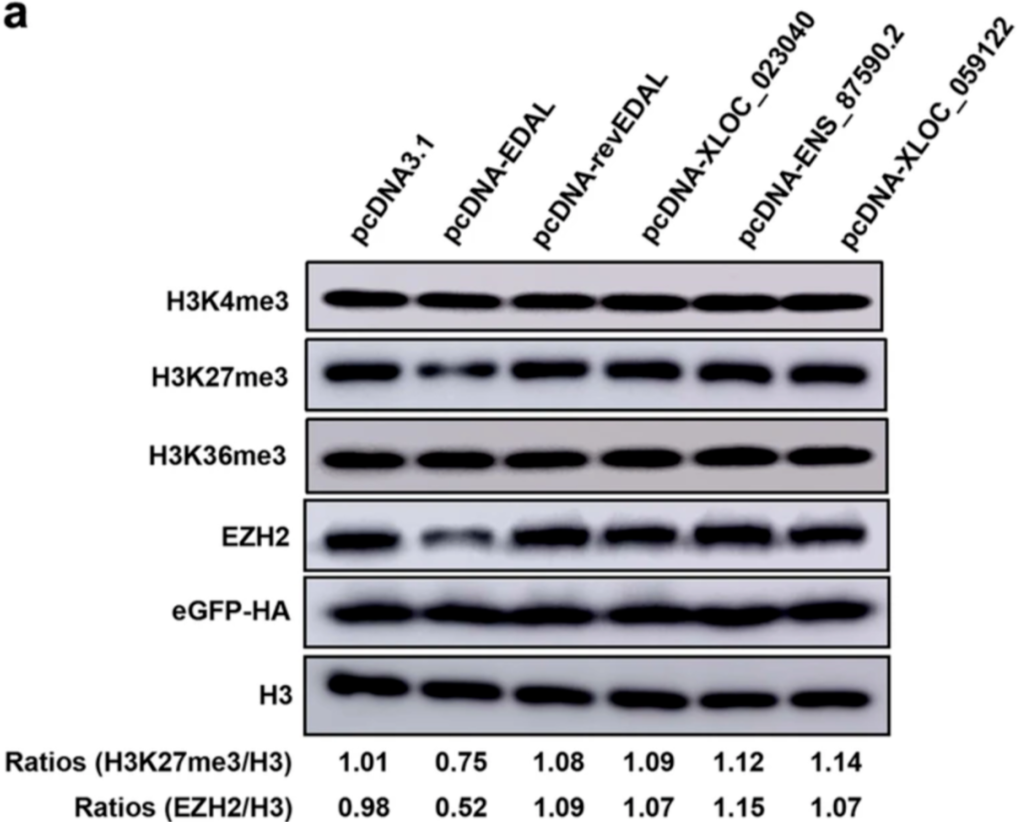 图片来源:Genome Biology 由于作者发现过表达 EDAL 的神经细胞中出现了组蛋白表观修饰标记 H3K27me3 的明显下调,作者进一步假设 EDAL 的抗病毒作用与表观遗传学调节有关。之后,作者顺藤摸瓜,找到了具有组蛋白甲基转移酶活性的 EZH2 (enhancer of zeste homolog 2) 在过表达 EDAL 后也出现了下调。通过敲低和敲入 EDAL,作者证明 EDAL 可以通过控制 EDAL 的含量以控制 H3K27me3 标记的发生。 由于 EDAL 不能改变 EZH2 在 mRNA 层面的表达,作者假设 EDAL 可能会直接导致 EZH2 的降解。为了验证这一猜想,作者使用 MG132 和氯化铵分别抑制了具有蛋白降解活性的蛋白酶体与溶酶体,并发现在溶酶体的功能被抑制后,EDAL 的过表达不再能促进 EZH2 的降解。免疫荧光染色则进一步证明了 EZH2 与溶酶体在位置上的重合。因此,这些数据表明 EDAL 是通过溶酶体促进 EZH2 降解来调节组蛋白的表观遗传学修饰。
图片来源:Genome Biology 由于作者发现过表达 EDAL 的神经细胞中出现了组蛋白表观修饰标记 H3K27me3 的明显下调,作者进一步假设 EDAL 的抗病毒作用与表观遗传学调节有关。之后,作者顺藤摸瓜,找到了具有组蛋白甲基转移酶活性的 EZH2 (enhancer of zeste homolog 2) 在过表达 EDAL 后也出现了下调。通过敲低和敲入 EDAL,作者证明 EDAL 可以通过控制 EDAL 的含量以控制 H3K27me3 标记的发生。 由于 EDAL 不能改变 EZH2 在 mRNA 层面的表达,作者假设 EDAL 可能会直接导致 EZH2 的降解。为了验证这一猜想,作者使用 MG132 和氯化铵分别抑制了具有蛋白降解活性的蛋白酶体与溶酶体,并发现在溶酶体的功能被抑制后,EDAL 的过表达不再能促进 EZH2 的降解。免疫荧光染色则进一步证明了 EZH2 与溶酶体在位置上的重合。因此,这些数据表明 EDAL 是通过溶酶体促进 EZH2 降解来调节组蛋白的表观遗传学修饰。
研究意义:
延伸阅读: 本文的通讯作者,本硕都就读于华中农业大学的赵凌教授自 2004 年赴美攻读博士学位起就开始研究狂犬病病毒。一研究,就在这个相对小众的领域耕耘了 16 年。2012 年回到母校后,赵凌教授带领团队在狂犬病领域先后发表多篇重要论文。
 图片来源:Journal of Virology 2017 年,赵凌教授就先后在病毒学顶级期刊 Journal of Virology 发表了题为 A Novel Rabies Vaccine Expressing CXCL13 Enhances Humoral Immunity by Recruiting both T Follicular Helper and Germinal Center B Cells[2] 与 Overexpression of IL-7 extends the humoral immune response induced by rabies vaccination[3] 的研究,提示我们如何进一步改善狂犬病疫苗的保护效果。 这次发现狂犬病病毒的重要「开关」,是赵凌教授十六年来不忘初心最好的回报。也希望相关药物尽快投入到临床使用之中,造福更多受到狂犬病病毒威胁的人们。
图片来源:Journal of Virology 2017 年,赵凌教授就先后在病毒学顶级期刊 Journal of Virology 发表了题为 A Novel Rabies Vaccine Expressing CXCL13 Enhances Humoral Immunity by Recruiting both T Follicular Helper and Germinal Center B Cells[2] 与 Overexpression of IL-7 extends the humoral immune response induced by rabies vaccination[3] 的研究,提示我们如何进一步改善狂犬病疫苗的保护效果。 这次发现狂犬病病毒的重要「开关」,是赵凌教授十六年来不忘初心最好的回报。也希望相关药物尽快投入到临床使用之中,造福更多受到狂犬病病毒威胁的人们。
但不幸的是,除了疫苗之外,一百年后的人类并没有其他手段来应对这种发病后死亡率接近 100% 的可怕疾病。
 图片来源:Genome Biology
图片来源:Genome Biology
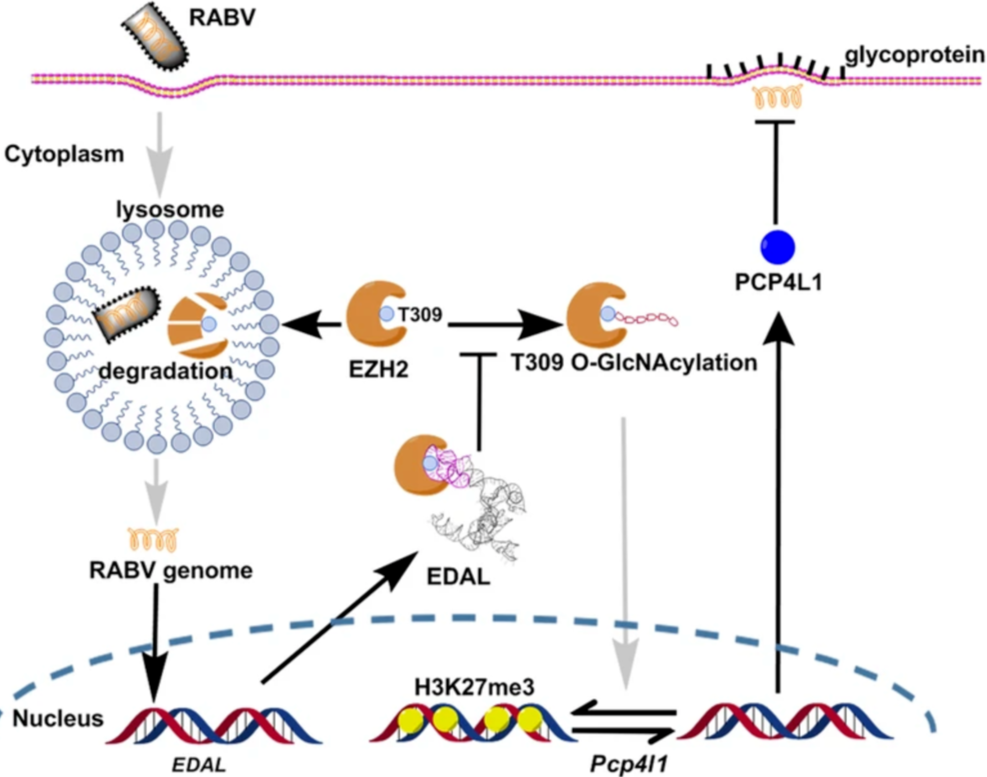
2020 年 9 月 1 月,来自华中农业大学的赵凌教授带领团队在 Genome Biology 发表了 A novel antiviral lncRNA, EDAL, shields a T309 O-GlcNAcylation site to promote EZH2 lysosomal degradation 的论文 [1],报道了神经系统中一种名为 EDAL 的长非编码 RNA (lncRNA) 在包括狂犬病病毒在内的嗜神经病毒中的抑制作用,为狂犬病病发后的治疗带来了新的曙光。
 图片来源:Genome Biology 为了探究大脑中 lncRNA 多样性与病毒易感性之间的关系,作者对感染了狂犬病病毒的神经细胞和对照组细胞进行了 RNA-seq,并筛选出 1434 个出现显著变化的 lncRNA。
图片来源:Genome Biology 为了探究大脑中 lncRNA 多样性与病毒易感性之间的关系,作者对感染了狂犬病病毒的神经细胞和对照组细胞进行了 RNA-seq,并筛选出 1434 个出现显著变化的 lncRNA。
通过对其中的 6 个进行克隆过表达,作者发现 XLOC_007537 在多种嗜神经病毒感染后都出现了显著上调,这种上调也仅仅在神经细胞系中出现。这证明 XLOC_007537 是一种病毒诱导的神经特异性 lncRNA。更重要的是,过表达 XLOC_007537 能够有效阻止狂犬病病毒感染神经细胞。由于后续实验表明 XLOC_007537 能够结合 EZH2 并导致后者的降解,所以作者将其命名为 EDAL (EZH2 degradation-associated lncRNA, EDAL)。
 图片来源:Genome Biology 为了进一步验证 EDAL 的功能,作者在 N2a 神经细胞中敲入与敲低了 EDAL,并发现敲入与敲低 EDAL 分别降低与增加了狂犬病病毒滴度。在其他诸如水疱性口炎病毒(VSV)、单纯疱疹病毒 (HSV-1) 与生里基森林病毒(SFV)的嗜神经病毒中,作者也观测到了类似的现象。这些数据证明 EDAL 能有效阻止多种嗜神经病毒的复制。
图片来源:Genome Biology 为了进一步验证 EDAL 的功能,作者在 N2a 神经细胞中敲入与敲低了 EDAL,并发现敲入与敲低 EDAL 分别降低与增加了狂犬病病毒滴度。在其他诸如水疱性口炎病毒(VSV)、单纯疱疹病毒 (HSV-1) 与生里基森林病毒(SFV)的嗜神经病毒中,作者也观测到了类似的现象。这些数据证明 EDAL 能有效阻止多种嗜神经病毒的复制。
 图片来源:Genome Biology 随后,作者对 EDAL 在狂犬病病毒中的作用进行了动物实验验证。感染携带 EDAL 基因的狂犬病病毒后,小鼠的存活率显著高于对照组小鼠,并在体重、临床评分、以及病毒拷贝等多项指标上出现了明显的改善。免疫组化染色也证明多个脑区中的狂犬病病毒 P 蛋白与 CD45+ 细胞数都出现了明显的降低。这些数据进一步佐证了 EDAL 对狂犬病病毒的抑制作用。
图片来源:Genome Biology 随后,作者对 EDAL 在狂犬病病毒中的作用进行了动物实验验证。感染携带 EDAL 基因的狂犬病病毒后,小鼠的存活率显著高于对照组小鼠,并在体重、临床评分、以及病毒拷贝等多项指标上出现了明显的改善。免疫组化染色也证明多个脑区中的狂犬病病毒 P 蛋白与 CD45+ 细胞数都出现了明显的降低。这些数据进一步佐证了 EDAL 对狂犬病病毒的抑制作用。
 图片来源:Genome Biology 由于作者发现过表达 EDAL 的神经细胞中出现了组蛋白表观修饰标记 H3K27me3 的明显下调,作者进一步假设 EDAL 的抗病毒作用与表观遗传学调节有关。之后,作者顺藤摸瓜,找到了具有组蛋白甲基转移酶活性的 EZH2 (enhancer of zeste homolog 2) 在过表达 EDAL 后也出现了下调。通过敲低和敲入 EDAL,作者证明 EDAL 可以通过控制 EDAL 的含量以控制 H3K27me3 标记的发生。 由于 EDAL 不能改变 EZH2 在 mRNA 层面的表达,作者假设 EDAL 可能会直接导致 EZH2 的降解。为了验证这一猜想,作者使用 MG132 和氯化铵分别抑制了具有蛋白降解活性的蛋白酶体与溶酶体,并发现在溶酶体的功能被抑制后,EDAL 的过表达不再能促进 EZH2 的降解。免疫荧光染色则进一步证明了 EZH2 与溶酶体在位置上的重合。因此,这些数据表明 EDAL 是通过溶酶体促进 EZH2 降解来调节组蛋白的表观遗传学修饰。
图片来源:Genome Biology 由于作者发现过表达 EDAL 的神经细胞中出现了组蛋白表观修饰标记 H3K27me3 的明显下调,作者进一步假设 EDAL 的抗病毒作用与表观遗传学调节有关。之后,作者顺藤摸瓜,找到了具有组蛋白甲基转移酶活性的 EZH2 (enhancer of zeste homolog 2) 在过表达 EDAL 后也出现了下调。通过敲低和敲入 EDAL,作者证明 EDAL 可以通过控制 EDAL 的含量以控制 H3K27me3 标记的发生。 由于 EDAL 不能改变 EZH2 在 mRNA 层面的表达,作者假设 EDAL 可能会直接导致 EZH2 的降解。为了验证这一猜想,作者使用 MG132 和氯化铵分别抑制了具有蛋白降解活性的蛋白酶体与溶酶体,并发现在溶酶体的功能被抑制后,EDAL 的过表达不再能促进 EZH2 的降解。免疫荧光染色则进一步证明了 EZH2 与溶酶体在位置上的重合。因此,这些数据表明 EDAL 是通过溶酶体促进 EZH2 降解来调节组蛋白的表观遗传学修饰。
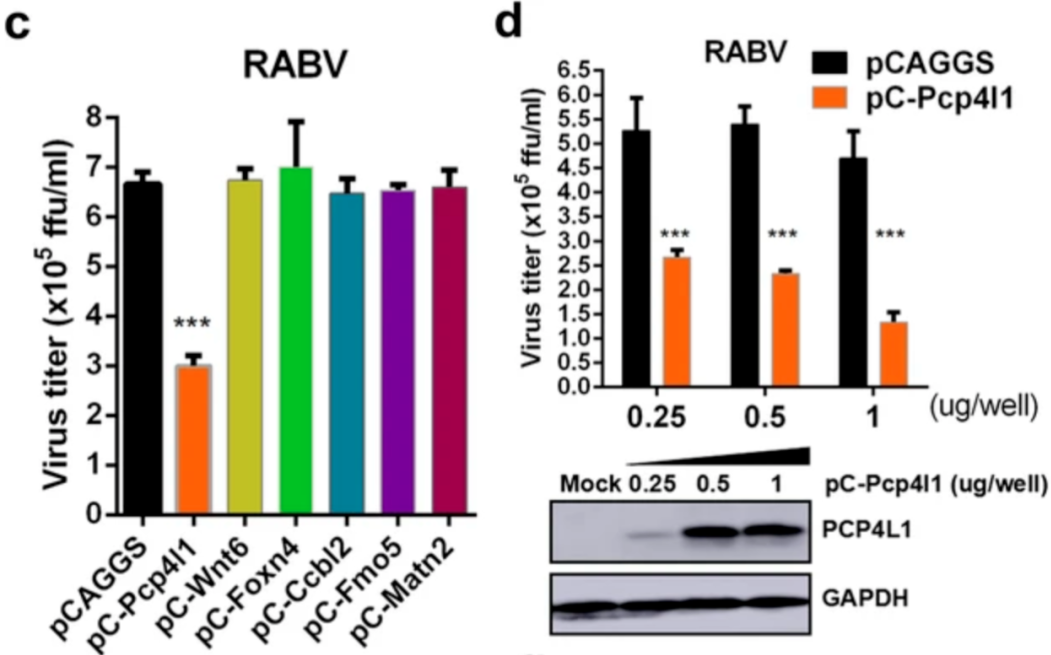
研究意义:
延伸阅读: 本文的通讯作者,本硕都就读于华中农业大学的赵凌教授自 2004 年赴美攻读博士学位起就开始研究狂犬病病毒。一研究,就在这个相对小众的领域耕耘了 16 年。2012 年回到母校后,赵凌教授带领团队在狂犬病领域先后发表多篇重要论文。

 图片来源:Journal of Virology 2017 年,赵凌教授就先后在病毒学顶级期刊 Journal of Virology 发表了题为 A Novel Rabies Vaccine Expressing CXCL13 Enhances Humoral Immunity by Recruiting both T Follicular Helper and Germinal Center B Cells[2] 与 Overexpression of IL-7 extends the humoral immune response induced by rabies vaccination[3] 的研究,提示我们如何进一步改善狂犬病疫苗的保护效果。 这次发现狂犬病病毒的重要「开关」,是赵凌教授十六年来不忘初心最好的回报。也希望相关药物尽快投入到临床使用之中,造福更多受到狂犬病病毒威胁的人们。
图片来源:Journal of Virology 2017 年,赵凌教授就先后在病毒学顶级期刊 Journal of Virology 发表了题为 A Novel Rabies Vaccine Expressing CXCL13 Enhances Humoral Immunity by Recruiting both T Follicular Helper and Germinal Center B Cells[2] 与 Overexpression of IL-7 extends the humoral immune response induced by rabies vaccination[3] 的研究,提示我们如何进一步改善狂犬病疫苗的保护效果。 这次发现狂犬病病毒的重要「开关」,是赵凌教授十六年来不忘初心最好的回报。也希望相关药物尽快投入到临床使用之中,造福更多受到狂犬病病毒威胁的人们。


你可能喜欢