艾滋病(AIDS)困扰人类近 40 年,艾滋病患者和 I 型艾滋病病毒(HIV-1)感染者因药物毒性、耐药性、药物无法完全清除 HIV-1 病毒储藏库、和停药后 HIV-1 病毒载量反弹等因素而饱受折磨。
此外,HIV-1 较易变异,病毒包膜糖蛋白 EnV 表面高度糖基化和构象遮蔽阻止中和抗体表位识别,加之对 HIV-1 感染的免疫保护机制缺乏清晰认识等,至今尚无可供预防使用的有效艾滋病疫苗问世。 诱导机体产生能中和不同亚型 HIV-1 的广谱中和抗体是艾滋病疫苗的重要目标。近年研究表明,在 HIV-1 自然感染过程中,部分感染者可产生针对膜蛋白保守区的广谱中和抗体 (broadly neutralizing antibodies, bNAbs)。bNAbs 一般在病毒感染后 2-3 年出现,能以极低浓度中和大部分艾滋病毒株。因此,对 bNAbs 的筛选分离、鉴定及 bNAbs 效应机制的探索是艾滋病疫苗研发的重要路径。 随着高通量中和抗体筛选和单克隆抗体分离技术飞速发展,科学家已从 HIV-1 感染者体内成功分离出上百种 bNAbs。对这些广谱中和抗体的识别表位进行鉴定发现,HIV-1 病毒包膜糖蛋白上存在几个主要的广谱中和表位区,分别为病毒包膜蛋白 gp120 上保守的 CD4 结合位点(CD4bs);V1V2 聚糖区(V1V2-glycan);V3 聚糖区(V3-glycan);gp120-gp41 交界面(gp120-gp41 interface);gp41 上的近膜端外部区域(membrane proximal external region,MPER)。
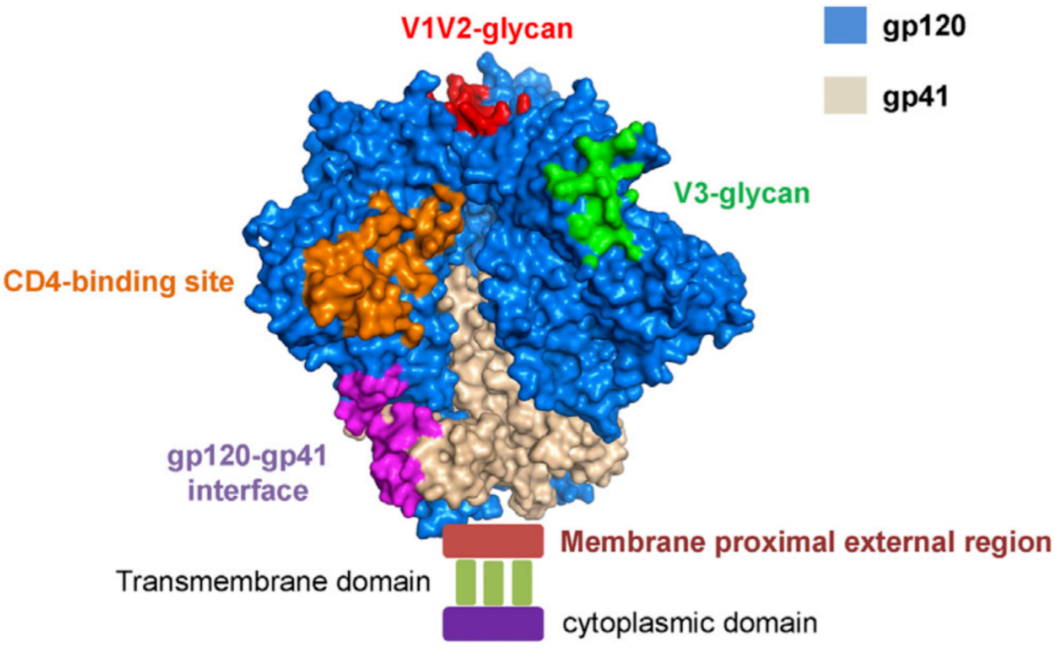 HIV-1 广谱中和抗体 bNAbs 结合位点图源:https://www.cell.com/cell-host-microbe/pdf/S1931-3128 (16) 30017-8.pdf 中国疾病预防控制中心艾滋病首席专家、南开大学艾滋病研究中心主任邵一鸣教授、美国 Scripps 研究所免疫学系和结构及计算生物学系主任朱江、 Ian A. Wilson 研究团队近日在 Science Advances 杂志发表了题为 A VH1-69 antibody lineage from an infected Chinese donor potently neutralizes HIV-1 by targeting the V3 glycan supersite 的研究工作, 报道了其分离自 HIV-1 感染患者的可有效中和 HIV-1 的两种 bNAbs(438-B11 和 438-D5), 为艾滋病疫苗研发提供了重要基础。 研究团队首先从编号为 CBJC438 的来自中国的一名艾滋病患者体内成功分离了 438-B11、438-D5 两种 bNAbs。
HIV-1 广谱中和抗体 bNAbs 结合位点图源:https://www.cell.com/cell-host-microbe/pdf/S1931-3128 (16) 30017-8.pdf 中国疾病预防控制中心艾滋病首席专家、南开大学艾滋病研究中心主任邵一鸣教授、美国 Scripps 研究所免疫学系和结构及计算生物学系主任朱江、 Ian A. Wilson 研究团队近日在 Science Advances 杂志发表了题为 A VH1-69 antibody lineage from an infected Chinese donor potently neutralizes HIV-1 by targeting the V3 glycan supersite 的研究工作, 报道了其分离自 HIV-1 感染患者的可有效中和 HIV-1 的两种 bNAbs(438-B11 和 438-D5), 为艾滋病疫苗研发提供了重要基础。 研究团队首先从编号为 CBJC438 的来自中国的一名艾滋病患者体内成功分离了 438-B11、438-D5 两种 bNAbs。
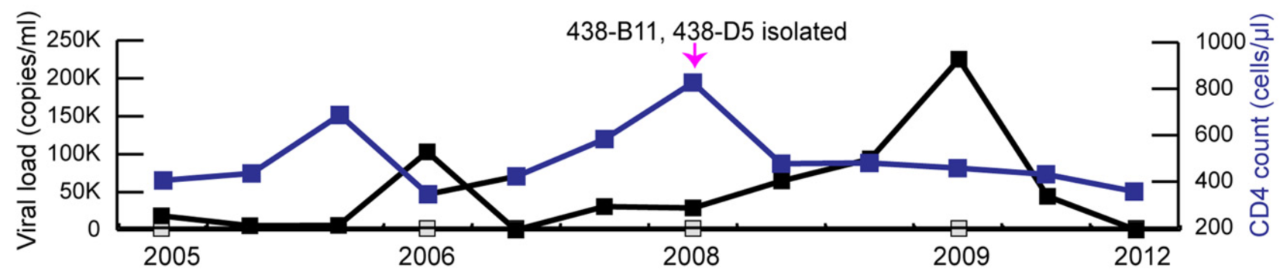 编号 CBJC438 的患者 HIV-1 病毒载量 2005 年至 2012 年从 18,700 拷贝 / 毫升增加到 225,000 拷贝 / 毫升。于 2008 年,从 CBJC438 患者体内分离 438-B11、438-D5 两种 bNAbs图片来源:Science Advances 血清中和试验检测表明,来自患者 CBJC438 体内的中和抗体具有较好的 HIV-1 中和能力。平均效价在 50 ~ 352 几何平均滴度(GMT)之间。
编号 CBJC438 的患者 HIV-1 病毒载量 2005 年至 2012 年从 18,700 拷贝 / 毫升增加到 225,000 拷贝 / 毫升。于 2008 年,从 CBJC438 患者体内分离 438-B11、438-D5 两种 bNAbs图片来源:Science Advances 血清中和试验检测表明,来自患者 CBJC438 体内的中和抗体具有较好的 HIV-1 中和能力。平均效价在 50 ~ 352 几何平均滴度(GMT)之间。
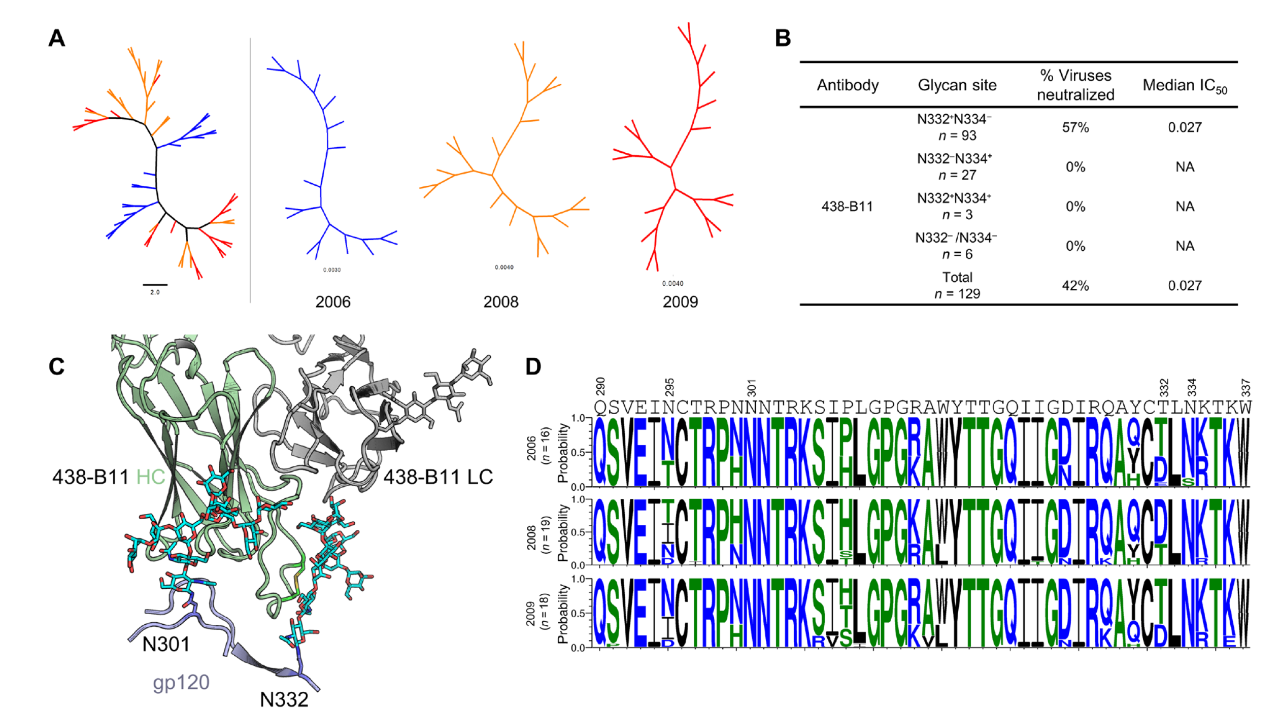
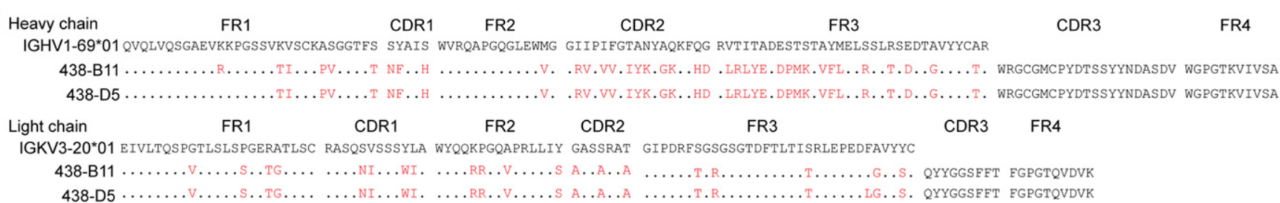 438-B11 和 438-D5 氨基酸序列分析图片来源:Science Advances 通过结构生物学分析,研究团队证实 438-B11/D5 表位位于 gp120,而非上文提到的 V1V2 聚糖区及 gp120-gp41 交界面,并随后解析了 438-B11 Fab 段结构,证实其可识别并结合 N332/ V3 聚糖区。
438-B11 和 438-D5 氨基酸序列分析图片来源:Science Advances 通过结构生物学分析,研究团队证实 438-B11/D5 表位位于 gp120,而非上文提到的 V1V2 聚糖区及 gp120-gp41 交界面,并随后解析了 438-B11 Fab 段结构,证实其可识别并结合 N332/ V3 聚糖区。
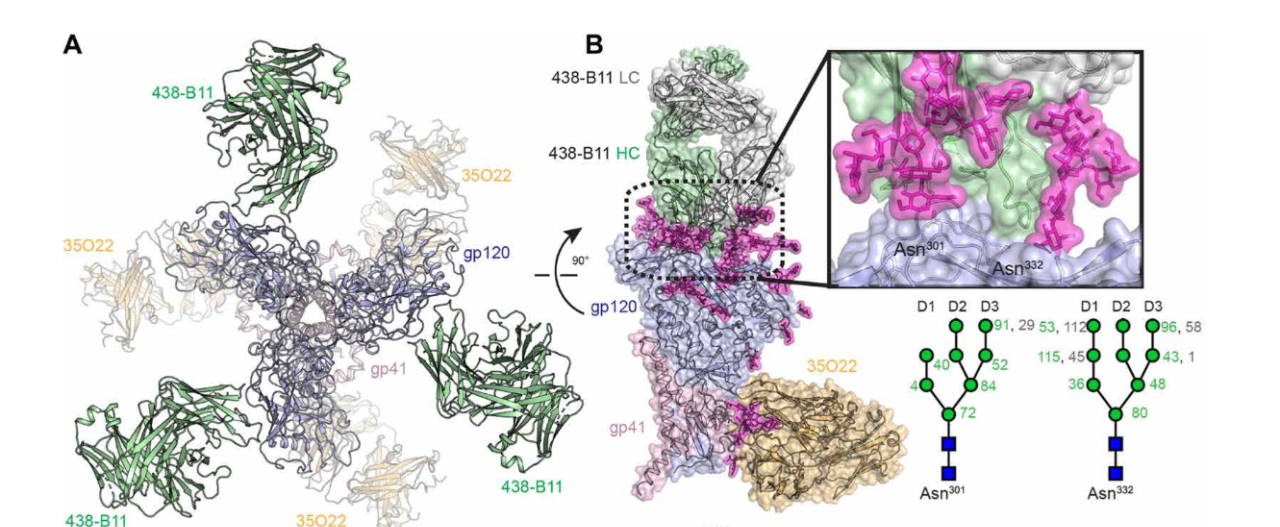 438-B11 的 HIV 结合表位定位图片来源:Science Advances V3-glycan 广谱中和表位主要是以 gp120 V3 上高度保守的 N332 糖基,以及 V3 基部氨基酸和邻近糖基组成的构象性表位。结构生物学分析结果表明,相比于 CD4bs 广谱中和抗体结合 Env 时被限制在一定角度,V3-glycan 广谱中和抗体在结合 Env 时可能呈现出多种角度的结合方式。
438-B11 的 HIV 结合表位定位图片来源:Science Advances V3-glycan 广谱中和表位主要是以 gp120 V3 上高度保守的 N332 糖基,以及 V3 基部氨基酸和邻近糖基组成的构象性表位。结构生物学分析结果表明,相比于 CD4bs 广谱中和抗体结合 Env 时被限制在一定角度,V3-glycan 广谱中和抗体在结合 Env 时可能呈现出多种角度的结合方式。
通过 NGS 技术,研究团队进一步对 CBJC438 患者体内 B 细胞受体库进行了长达 8 年的追踪,通过对捕获的 400 余万条抗体结果分析,证实了基因频率、HCDR3 循环的长度随时间的显著变化。此外,IGHV1-69 出现的高频率表明 438-B11/D5 谱系可能在 2008 年之前经历了一次显著的扩张,而这段时间恰好是 HIV-1 病毒载量最低的时间。
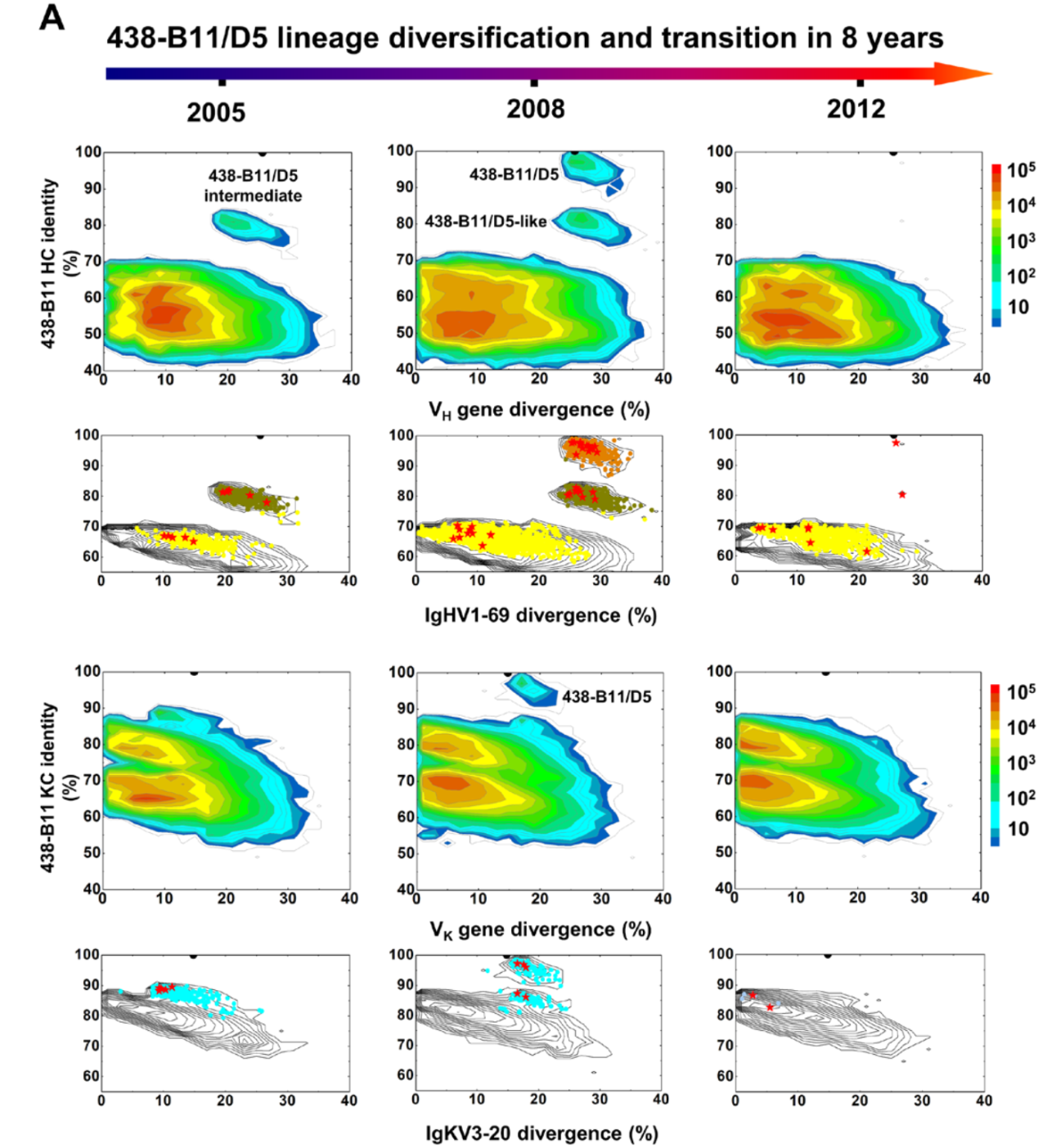 438-B11/D5 谱系发展的纵向分析图片来源:Science Advances
438-B11/D5 谱系发展的纵向分析图片来源:Science Advances
小结
安全有效的艾滋病疫苗和实现功能性治愈是艾滋病治疗尚待攻克的两大难题。在抗击艾滋病的艰难历程中,人类从未停止科研探索的步伐,中和抗体作为最前沿的研究热点之一被寄予厚望。2018 年,美国食品药品管理局批准了首个广谱中和抗体为抗 HIV 单克隆抗体药物的研发产生巨大的推动。 从 HIV 患者体内筛选 HIV-1 广谱中和抗体的关键氨基酸位点,分析来源不同时间序列节点的中和抗体氨基酸序列,对存在频繁变异的关键氨基酸位点进行回复突变,比较突变前后的假病毒与自体血浆中和敏感性的差异,并通过纵向追踪进行验证筛选有效广谱中和抗体,为艾滋病疫苗的研发提供了重要策略。 延伸阅读 Michel C. Nussenzweig 研究团队 2019 年在 Nature 杂志上发表题为 Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques 的研究工作, 为基于 HIV-1 病毒 V3 - 聚糖的艾滋病疫苗提供了新的实验数据支撑。
此外,HIV-1 较易变异,病毒包膜糖蛋白 EnV 表面高度糖基化和构象遮蔽阻止中和抗体表位识别,加之对 HIV-1 感染的免疫保护机制缺乏清晰认识等,至今尚无可供预防使用的有效艾滋病疫苗问世。 诱导机体产生能中和不同亚型 HIV-1 的广谱中和抗体是艾滋病疫苗的重要目标。近年研究表明,在 HIV-1 自然感染过程中,部分感染者可产生针对膜蛋白保守区的广谱中和抗体 (broadly neutralizing antibodies, bNAbs)。bNAbs 一般在病毒感染后 2-3 年出现,能以极低浓度中和大部分艾滋病毒株。因此,对 bNAbs 的筛选分离、鉴定及 bNAbs 效应机制的探索是艾滋病疫苗研发的重要路径。 随着高通量中和抗体筛选和单克隆抗体分离技术飞速发展,科学家已从 HIV-1 感染者体内成功分离出上百种 bNAbs。对这些广谱中和抗体的识别表位进行鉴定发现,HIV-1 病毒包膜糖蛋白上存在几个主要的广谱中和表位区,分别为病毒包膜蛋白 gp120 上保守的 CD4 结合位点(CD4bs);V1V2 聚糖区(V1V2-glycan);V3 聚糖区(V3-glycan);gp120-gp41 交界面(gp120-gp41 interface);gp41 上的近膜端外部区域(membrane proximal external region,MPER)。
 HIV-1 广谱中和抗体 bNAbs 结合位点图源:https://www.cell.com/cell-host-microbe/pdf/S1931-3128 (16) 30017-8.pdf 中国疾病预防控制中心艾滋病首席专家、南开大学艾滋病研究中心主任邵一鸣教授、美国 Scripps 研究所免疫学系和结构及计算生物学系主任朱江、 Ian A. Wilson 研究团队近日在 Science Advances 杂志发表了题为 A VH1-69 antibody lineage from an infected Chinese donor potently neutralizes HIV-1 by targeting the V3 glycan supersite 的研究工作, 报道了其分离自 HIV-1 感染患者的可有效中和 HIV-1 的两种 bNAbs(438-B11 和 438-D5), 为艾滋病疫苗研发提供了重要基础。 研究团队首先从编号为 CBJC438 的来自中国的一名艾滋病患者体内成功分离了 438-B11、438-D5 两种 bNAbs。
HIV-1 广谱中和抗体 bNAbs 结合位点图源:https://www.cell.com/cell-host-microbe/pdf/S1931-3128 (16) 30017-8.pdf 中国疾病预防控制中心艾滋病首席专家、南开大学艾滋病研究中心主任邵一鸣教授、美国 Scripps 研究所免疫学系和结构及计算生物学系主任朱江、 Ian A. Wilson 研究团队近日在 Science Advances 杂志发表了题为 A VH1-69 antibody lineage from an infected Chinese donor potently neutralizes HIV-1 by targeting the V3 glycan supersite 的研究工作, 报道了其分离自 HIV-1 感染患者的可有效中和 HIV-1 的两种 bNAbs(438-B11 和 438-D5), 为艾滋病疫苗研发提供了重要基础。 研究团队首先从编号为 CBJC438 的来自中国的一名艾滋病患者体内成功分离了 438-B11、438-D5 两种 bNAbs。
 编号 CBJC438 的患者 HIV-1 病毒载量 2005 年至 2012 年从 18,700 拷贝 / 毫升增加到 225,000 拷贝 / 毫升。于 2008 年,从 CBJC438 患者体内分离 438-B11、438-D5 两种 bNAbs图片来源:Science Advances 血清中和试验检测表明,来自患者 CBJC438 体内的中和抗体具有较好的 HIV-1 中和能力。平均效价在 50 ~ 352 几何平均滴度(GMT)之间。
编号 CBJC438 的患者 HIV-1 病毒载量 2005 年至 2012 年从 18,700 拷贝 / 毫升增加到 225,000 拷贝 / 毫升。于 2008 年,从 CBJC438 患者体内分离 438-B11、438-D5 两种 bNAbs图片来源:Science Advances 血清中和试验检测表明,来自患者 CBJC438 体内的中和抗体具有较好的 HIV-1 中和能力。平均效价在 50 ~ 352 几何平均滴度(GMT)之间。
 438-B11 和 438-D5 氨基酸序列分析图片来源:Science Advances 通过结构生物学分析,研究团队证实 438-B11/D5 表位位于 gp120,而非上文提到的 V1V2 聚糖区及 gp120-gp41 交界面,并随后解析了 438-B11 Fab 段结构,证实其可识别并结合 N332/ V3 聚糖区。
438-B11 和 438-D5 氨基酸序列分析图片来源:Science Advances 通过结构生物学分析,研究团队证实 438-B11/D5 表位位于 gp120,而非上文提到的 V1V2 聚糖区及 gp120-gp41 交界面,并随后解析了 438-B11 Fab 段结构,证实其可识别并结合 N332/ V3 聚糖区。
 438-B11 的 HIV 结合表位定位图片来源:Science Advances V3-glycan 广谱中和表位主要是以 gp120 V3 上高度保守的 N332 糖基,以及 V3 基部氨基酸和邻近糖基组成的构象性表位。结构生物学分析结果表明,相比于 CD4bs 广谱中和抗体结合 Env 时被限制在一定角度,V3-glycan 广谱中和抗体在结合 Env 时可能呈现出多种角度的结合方式。
438-B11 的 HIV 结合表位定位图片来源:Science Advances V3-glycan 广谱中和表位主要是以 gp120 V3 上高度保守的 N332 糖基,以及 V3 基部氨基酸和邻近糖基组成的构象性表位。结构生物学分析结果表明,相比于 CD4bs 广谱中和抗体结合 Env 时被限制在一定角度,V3-glycan 广谱中和抗体在结合 Env 时可能呈现出多种角度的结合方式。

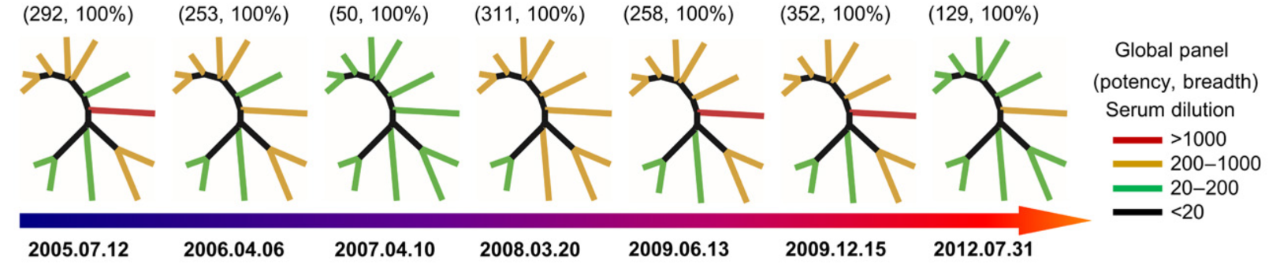
通过 NGS 技术,研究团队进一步对 CBJC438 患者体内 B 细胞受体库进行了长达 8 年的追踪,通过对捕获的 400 余万条抗体结果分析,证实了基因频率、HCDR3 循环的长度随时间的显著变化。此外,IGHV1-69 出现的高频率表明 438-B11/D5 谱系可能在 2008 年之前经历了一次显著的扩张,而这段时间恰好是 HIV-1 病毒载量最低的时间。
 438-B11/D5 谱系发展的纵向分析图片来源:Science Advances
438-B11/D5 谱系发展的纵向分析图片来源:Science Advances
进一步,研究团队调查快速进化的 438-B11/D5 谱系中的功能变异,发现不同时间点的多个变异均表现出相似中和效果,提示该 bNAb 系抗体功能对 HC 突变更为敏感,验证了 438-B11/D5 亚型的功能,也证实了 438-B11/D5 对 HIV-1 包膜糖蛋白 Env 识别功能。
小结
安全有效的艾滋病疫苗和实现功能性治愈是艾滋病治疗尚待攻克的两大难题。在抗击艾滋病的艰难历程中,人类从未停止科研探索的步伐,中和抗体作为最前沿的研究热点之一被寄予厚望。2018 年,美国食品药品管理局批准了首个广谱中和抗体为抗 HIV 单克隆抗体药物的研发产生巨大的推动。 从 HIV 患者体内筛选 HIV-1 广谱中和抗体的关键氨基酸位点,分析来源不同时间序列节点的中和抗体氨基酸序列,对存在频繁变异的关键氨基酸位点进行回复突变,比较突变前后的假病毒与自体血浆中和敏感性的差异,并通过纵向追踪进行验证筛选有效广谱中和抗体,为艾滋病疫苗的研发提供了重要策略。 延伸阅读 Michel C. Nussenzweig 研究团队 2019 年在 Nature 杂志上发表题为 Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques 的研究工作, 为基于 HIV-1 病毒 V3 - 聚糖的艾滋病疫苗提供了新的实验数据支撑。



你可能喜欢