肌肉疾病的遗传多样性非常广泛,需要新的工具来研究疾病的发病机制和测试新的治疗干预措施。从病人身上分离出来的细胞作为特定模型的来源,这些模型允许在病人自身的基因环境中研究疾病,这些细胞模型正变得越来越重要。
尿作为人类原代细胞的来源
开发特定于患者的细胞模型依赖于容易获得的细胞源,如果细胞不是来自感兴趣的组织类型,则需要一个强大的重新编程过程。肌肉活检是有创性的,有时对于肌肉质量受限的患者来说是有问题的。或者,需要较少侵入性分离方法的细胞更容易获得,也容易用于研究。研究中常用的人类细胞包括来自皮肤活检的血细胞或真皮成纤维细胞。虽然与肌肉活检相比侵入性要小得多,但血液尤其是皮肤的采集,尤其是来自儿科人群的血液采集,会带来相关的压力。
尿液是一种无创的、容易获得的患者特异性细胞来源。从尿液中分离细胞的最初描述是在20世纪70年代末,尽管它从未被广泛用作产生人类原代培养物的来源。最近的研究重新激发了人们对尿源性细胞(udc)的兴趣,并且随着分离技术的改进,udc很容易从各个年龄段的个体中培养出来。通常,UDC培养基可以在采集后2-3周内建立。UDCs具有很高的增殖能力和固有的再编程可塑性。此外,尿液采集是无创性的,可以最大限度地减少与样本采集相关的任何压力,这是对儿科人群进行采样时所需要的属性。
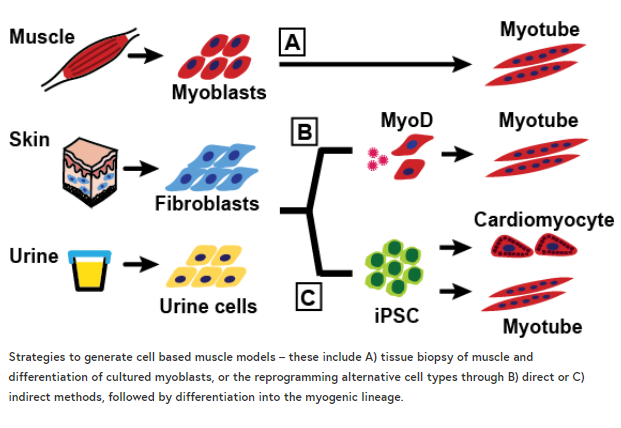
重新编程尿源性细胞研究肌肉疾病
通过间接重编程,原代细胞首先去分化为诱导多能干细胞(iPSCs),然后根据组织特异性培养条件分化为多种细胞类型。iPSCs可以很容易地分化为心肌细胞或神经元样细胞系,尽管分化培养物通常是混合细胞群。相比之下,直接重编程消除了干细胞阶段,而是涉及诱导或过度表达组织特异性“主调节因子”基因,直接将原代培养细胞带入所需的谱系。三十多年前,肌萎缩成纤维细胞直接肌源性重编程是研究转录因子作用的中心实验,因为肌萎缩通过前馈机制控制早期和晚期基因在肌肉发育中的时间表达。将iPSCs间接重编程成骨骼肌是一项更具挑战性的工作,而从iPSCs中生成心肌细胞的相对容易性使得这种细胞类型被用作骨骼肌的替代物。从iPSC中产生骨骼肌培养的最新进展令人鼓舞,尽管在培养系统内部和跨培养系统的可变结果仍然需要解决。
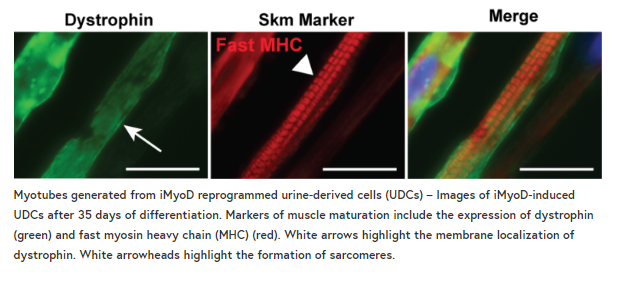
在发表在《骨骼肌》杂志上的一份新报告中,我们详细介绍了一种直接将UDCs重新编程成肌源性谱系并诱导MyoD过度表达的方法。我们发现一个强大的肌瘤表达脉冲驱动细胞进入成熟的肌肉样表型,完整的有组织肌节和自发抽搐的肌管。当应用于肌营养不良患者的UDCs时,该方法产生了反映原发性疾病表型的成熟肌源性培养物。这个方法详细说明了一个简单的策略,从几乎任何人体的骨骼肌体外模型。
尿源性细胞:药物和细胞治疗的工具
目前,我们正在利用这些特定于患者的模型来开发和测试新的治疗方法,包括基因矫正和基因编辑。一个目标是开发一种外显子跳跃疗法来治疗由编码g-sar基因的SGCG移码突变引起的肢带型肌营养不良2C(LGMD 2C)科格利坎。多个患者细胞模型的可用性使我们可以测试同一SGCG基因不同突变的常用疗法,同时也可以开发针对患者特异性SGCG突变的专门疗法。
在骨骼肌报告中,我们还描述了尿液来源细胞对CRISPR/Cas9技术进行基因编辑的适应性。利用这个新的和强大的系统来纠正导致杜氏肌营养不良症的突变,为潜在的致病突变基因纠正提供了概念证明。或者,CRISPR/Cas9介导的基因编辑可以将突变插入到控制细胞系中,创建一个“碟形疾病”模型,允许在没有直接接触患者的情况下研究疾病。例如,使用这种方法可以产生一系列肌营养不良蛋白基因突变,以便在相同的遗传背景下测试多个不同突变的外显子跳跃。尿细胞分离的相对容易,加上产生基因编辑的单细胞克隆的能力,使这成为一个有吸引力的平台CRISPR/Cas9技术。
尿源细胞与精密药物
与人类疾病的起因或恶化有关的基因组突变数量正在稳步增加。随着我们知识范围的扩大,需要新的工具来研究疾病的机制和评估新的治疗干预措施。一种现成的、非侵入性的细胞来源,从中产生组织特异性模型肌肉样细胞是非常有用的,特别是对于开发特定于患者的治疗方案,这是走向精确医学的关键组成部分。


你可能喜欢