鼠伤寒沙门氏菌回复突变试验(Ames 试验,Salmonella Typhimurium / Reverse Mutation Assay)于 1975 年建立并不断发展完善,目前已被世界各国广为采用,已经成为毒理学实验室必需开展的重要实验项目。Ames 实验用于检测待分析物质的致突变作用,该验灵敏、高效、检测范围广。
Ames 试验原理
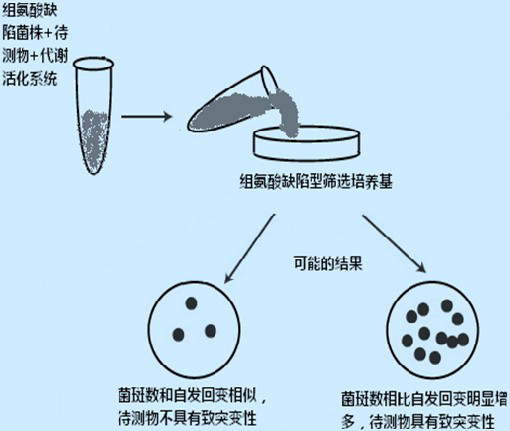
Ames 试验利用鼠伤寒沙门氏组氨酸营养缺陷型菌株,该缺陷型菌株不能合成组氨酸,故在缺乏组氨酸的培养基上,仅少数自发回复突变的细菌生长;假如有致突变物存在,则营养缺陷型的细菌诱导回复突变成原养型,因而能生长形成菌落,据此判断受试物是否为致突变物。某些致突变物需要代谢活化后才能引起回复突变, 故需加入经诱导剂诱导的大鼠肝制备的 S9 混合液。北京汇智泰康医药技术有限公司针对 Ames 试验开发 Ames 试剂盒, 本试剂盒省去了培养基成分准备、诱导 S9 制备、菌株 鉴定、菌株培养等时间,可以直接使用,大大缩短了实验周期;试剂盒各成分均经过严格的质量检测,无杂菌污染,菌株特性与活菌数目以及诱导 S9 活性均符合 Ames 试验要求,实验结果准确、可靠、重现性高。Ames 试剂盒应用广泛,可进行食品与饮用水、化学品、洗涤剂、消毒剂、食品添加剂、药物残留、化妆品、容器与包装材料等多个方面的遗传毒理学检测。
Ames 试验导则
1 范围
本规范确定了鼠伤寒沙门氏菌/回复突变试验的基本原则、要求和方法。
本规范适用于化妆品原料及其产品的基因突变检测。
2 规范性引用文件
OECD Guidelines for Testing of Chemicals (No.471,Adopted:21,July 1997)。
3 定义
3.1 回复突变(Reverse mutation)
细菌在化学致突变物作用下由营养缺陷型回变到原养型(prototroph)。
3.2 基因突变 (Gene mutation)
在化学致突变物作用下细胞DNA中碱基对的排列顺序发生变化。
3.3 碱基置换突变 (Base substitution mutation)
引起 DNA 链上一个或几个碱基对的置换。
碱基置换有转换(transition)和颠换(transversion)两种形式。
转换是 DNA 链上的一个嘧啶被另一嘧啶所替代,或一个嘌呤被另一嘌呤所代替。
颠换是 DNA 链上的一个嘧啶被另一嘌呤所替代,或一个嘌呤被另一嘧啶所代替。
3.4 移码突变( Frameshift mutation)
引起 DNA 链上增加或缺失一个或多个碱基对。
3.5 鼠伤寒沙门氏菌/回复突变试验( Salmonella typhimurium/reverse mutation assay)
利用一组鼠伤寒沙门氏组氨酸缺陷型试验菌株测定引起沙门氏菌碱基置换或移码突变的化学物质所诱发的组氨酸缺陷型(his-)→原养型(his+)回复突变的试验方法。
3.6 S9
经多氯联苯(PCB混合物)或苯巴比妥钠和β-萘黄酮结合诱导的大鼠制备肝匀浆,在 9000 g 下离心 10 min 后的肝匀浆上清液。
4 原理
鼠伤寒沙门氏组氨酸营养缺陷型菌株不能合成组氨酸,故在缺乏组氨酸的培养基上,仅少数自发回复突变的细菌生长。假如有致突变物存在,则营养缺陷型的细菌回复突变成原养型,因而能生长形成菌落,据此判断受试物是否为致突变物。可使用北京汇智泰康医药技术有限公司研发生产的 Ames 试剂盒,试剂盒省去了培养基成分准备、诱导 S9 制备、菌株 鉴定、菌株培养等时间,可以直接使用,大大缩短了实验周期。
某些致突变物需要代谢活化后才能引起回复突变, 故需加入经诱导剂诱导的大鼠肝制备的 S9 混合液。
5 仪器和设备
培养箱、恒温水浴、振荡水浴摇床、压力蒸汽消毒器、干热烤箱、低温冰箱(- 80 ℃)或液氮生物容器、普通冰箱、天平(精密度 0.1 g 和 0.0001 g)、混匀振荡器、匀浆器、菌落计数器、低温高速离心机,玻璃器皿等。
6 培养基和试剂
6.1 0.5 mmol/L 组氨酸 -0.5 mmol/L 生物素溶液
成分: L-组氨酸(MW 155) 78 mg
D-生物素(MW 244) 122 mg
加蒸馏水至 1000 mL
配制:将上述成分加热,以溶解生物素,然后在 0.068 MPa 下高压灭菌 20 min。贮于 4 ℃ 冰箱。
6.2 顶层琼脂培养基
成分: 琼脂粉 1.2 g
氯化钠 1.0 g
加蒸馏水至 200 mL
配制:上述成分混合后,于 0.103 MPa 下高压灭菌 30 min。实验时,加入 0.5 mmol/L组氨酸—0.5 mmol/L生物素溶液 20 mL。
6.3 Vogel-Bonner (V-B) 培养基 E
成分:枸椽酸(C6H8O7·H2O) 100 g
磷酸氢二钾(K2HPO4) 500 g
磷酸氢铵钠(NaNH4HPO4·4 H2O) 175 g
硫酸镁(MgSO4·7 H2O) 10 g
加蒸馏水至 1000 mL
配制:先将前三种成分加热溶解后,再将溶解的硫酸镁缓缓倒入容量瓶中,加蒸馏水至 1000 mL。于 0.103 MPa 下高压灭菌 30 min。储于 4 ℃ 冰箱。
6.4 20% 葡萄糖溶液
成分:葡萄糖 200 g
加蒸馏水至 1000 mL
配制:加少量蒸馏水加温溶解葡萄糖,再加蒸馏水至 1000 mL。于 0.068 MPa 下高压灭菌 20 min。储于 4 ℃ 冰箱。
6.5 底层琼脂培养基
成分:琼脂粉 7.5 g
蒸馏水 480 mL
V-B培养基E 10 mL
20%葡萄糖溶液 10 mL
配制:首先将前两种成分于 0.103 MPa 下高压灭菌 30 min后,再加入后两种成分,充分混匀倒底层平板。按每皿 25 mL 制备平板,冷凝固化后倒置于 37 ℃ 培养箱中 24 h,备用。
6.6 营养肉汤培养基
成分:牛肉膏 2.5 g
胰 胨 5.0 g
磷酸氢二钾(K2HPO4) 1.0 g
加蒸馏水至 500 mL
配制:将上述成分混合后,于 0.103 MPa 下高压灭菌 30 min。储于 4 ℃ 冰箱。
6.7 盐溶液(1.65mol/L KCl+ 0.4mol/L MgCl2)
成分:氯化钾(KCl) 61.5 g
氯化镁(MgCl2·6 H2O) 40.7 g
加蒸馏水至 500 mL
配制:在水中溶解上述成分后,于 0.103 MPa 下高压灭菌 30 min。储于 4 ℃ 冰箱。
6.8 0.2mol/L 磷酸盐缓冲液(pH7.4)
成分:磷酸二氢钠(NaH2PO4·2 H2O) 2.965 g
磷酸氢二钠(Na2HPO4·12 H2O) 29.015 g
加蒸馏水至 500 mL
配制:溶解上述成分后,于 0.103 MPa 下高压灭菌 30 min。储于 4 ℃ 冰箱。
6.9 S9 混合液
成分 每毫升 S9 混合液
肝 S9 100 ml
盐溶液 20 ml
灭菌蒸馏水 380 ml
0.2mol/L磷酸盐缓冲液 500 ml
辅酶II(NADP) 4 mmol
6 -磷酸葡萄糖(G- 6 -P) 5 mmol
配制:将辅酶II和6 -磷酸葡萄糖置于灭菌三角瓶内称重,然后按上述相反的次序加入各种成分, 使肝 S9 加到已有缓冲液的溶液中。该混合液必须临用现配,并保存于冰水浴中。实验结束,剩余 S9 混合液应该丢弃。
6.10 菌株鉴定用和特殊用途试剂
6.10.1 组氨酸—生物素平板
成分:琼脂粉 15 g
蒸馏水 944mL
(V-B)培养基E 20 mL
20%葡萄糖 20 mL
灭菌盐酸组氨酸水溶液(0.5 g / 100 mL) 10 mL
灭菌 0.5 mmol/L生物素溶液 6 mL
配制:高压灭菌琼脂和水后,将灭菌 20% 葡萄糖,V-B 培养基和组氨酸溶液加进热的琼脂溶液中。待溶液稍为冷却后,加入灭菌生物素,混匀,浇制平板。
6.10.2 氨苄青霉素平板和氨苄青霉素/四环素平板
成分:琼脂粉 15 g
蒸馏水 940 mL
(V-B)盐溶液 20 mL
20%葡萄糖 20 mL
灭菌盐酸组氨酸溶液(0.5 g / 100 mL) 10 mL
灭菌 0.5 mmol/L生物素溶液 6 mL
氨苄青霉素溶液(8 mg/mL于 0.02 mol/L NaOH 中) 3.15 mL
四环素溶液(8 mg/mL 于 0.02 mol/L HCl中) 0.25 mL
配制:琼脂和水高压灭菌 20 min,将无菌的葡萄糖、VB 盐溶液和组氨酸—生物素溶液加进热的溶液中去,混匀。冷却至大约 50 ℃,无菌条件下加入四环素溶液和/或氨苄青霉素溶液。
应该在倾注琼脂平板后几天内,制备主平板。
6.10.3 营养琼脂平板
成份:琼脂粉 7.5 g
营养肉汤培养基 500 mL
配制:于 0.103 MPa 下高压灭菌 30 min后倾注平板。
7 试验菌株及其生物学特性鉴定
7.1 试验菌株
采用 TA97、TA98、TA100 和 TA102 一组标准测试菌株。
7.2 生物学特性鉴定
新获得的或长期保存的菌种,在试验前必须进行菌株的生物特性鉴定。菌株鉴定的判断标准,如表1所示。
表1 试验菌株鉴定的判断标准
菌株 |
组氨酸缺陷 |
脂多糖屏障缺损 |
氨苄青霉素抗性 |
切除修复缺损 |
四环素抗性 |
自发回变菌落数* |
TA97 TA98 TA100 TA102 |
+ + + + |
+ + + + |
+ + + + |
+ + + - |
- - - + |
90-180 30-50 100-200 240-320 |
注 |
「+」表示需要组氨酸 |
「+」表示具有 rfa 突变 |
「+」表示具有 R 因子 |
「+」表示具有 △uvrB 突变 |
「+」表示具有 pAQ1 质粒 |
*在体外代谢活化条件下自发回变菌落数略增 |
7.2.1 组氨酸缺陷
原理:组氨酸缺陷型试验菌株本身不能合成组氨酸,只能在补充组氨酸的培养基上生长,而在缺乏组氨酸的培养基上,则不能生长。
鉴定方法:将测试菌株增菌液分别于含组氨酸培养基平板和无组氨酸平板上划线,于 37 ℃下培养 24 h 后观察结果。
结果判断:组氨酸缺陷型菌株在含组氨酸平板上生长,而在无组氨酸平板上则不能生长。
7.2.2 脂多糖屏障缺损
原理:具有深粗糙(rfa)的菌株,其表面一层脂多糖屏障缺损,因此一些大分子物质如结晶紫能穿透菌膜进入菌体,从而抑制其生长,而野生型菌株则不受其影响。
鉴定方法:吸取待测菌株增菌液 0.1 mL 于营养琼脂平板上划线,然后将浸湿的 0.1% 结晶紫溶液滤纸条与划线处交叉放置。37 ℃下培养 24 h 后观察结果。
结果判断:假若待测菌在滤纸条与划线交叉处出现一透明菌带,说明该待测菌株具有 rfa 突变。
7.2.3 氨苄青霉素抗性
原理:含 R 因子的试验菌株对氨苄青霉素有抗性。因为 R 因子不太稳定,容易丢失,故用氨苄青霉素确定该质粒存在与否。
鉴定方法:吸取待测菌株增菌液 0.1 mL,在氨苄青霉素平板上划线,37 ℃ 下培养 24 h 后观察结果。
结果判断;假若测试菌在氨苄青霉素平板上生长,说明该测试菌具有抗氨苄青霉素作用,表示含 R 因子,否则,表示测试菌不含 R 因子或 R 因子丢失。
7.2.4 紫外线敏感性
原理:具有 △uvrB 突变的菌株对紫外线敏感,当受到紫外线照射后,不能生长,而具有野生型切除修复酶的菌株,则能照常生长。
鉴定方法:吸取待测菌株增菌液 0.1 mL 于营养琼脂平板上划线,用黑纸盖住平板的一半,置紫外灯下照射(15W,距离 33 cm)8 秒钟。置 37 ℃下孵育 24 h 后观察结果。
结果判断:具有 △uvrB 突变的菌株对紫外线敏感,经辐射后细菌不生长,而具有完整的切除修复系统的菌株,则照常生长。
7.2.5 四环素抗性
原理:具有 pAQI 的菌株对四环素有抗性。
鉴定方法:吸取待测菌株增菌液 0.1 mL 于氨苄青霉素/四环素平板上划线,置 37 ℃下孵育 24 h 后观察结果。
结果判断:假若测试菌照常在氨苄青霉素/四环素平板上生长,表明该测试菌株对氨苄青霉素和四环素两者有抗性,具有 pAQI 质粒,否则,说明测试菌株不含 pAQI 质粒。
7.2.6 自发回变
原理:每种试验菌株都以一定的频率自发地产生回变,称为自发回变。这种自发回变是每种试验菌株的一项特性。
鉴定方法:将待测菌株增菌液 0.1 mL 加到 2 mL 含组氨酸—生物素的顶层琼脂培养基的试管内,混匀后铺到于底层琼脂平板上,待琼脂固化后,置 37 ℃ 培养箱中孵育 48 h 后记数每皿回变菌落数。
结果判断:每种标准测试菌株的自发回变菌落数应符合表 1 要求。经体外代谢活化后的自发回变菌落数,要比直接作用下的略高。
7.2.7 回变特性—诊断性试验
原理:每种试验菌株对诊断性诱变剂回变作用的性质以及 S9 混合液的效应不一。
鉴定方法:按照平板掺入试验的操作步骤进行。将受试物换成诊断性诱变剂。
结果判断:标准菌株对某些诊断性诱变剂特有的回变结果参见表 2。
表 2 测试菌株的回变性
诱变剂 |
剂量(mg) |
S9 |
TA97 |
TA98 |
TA100 |
TA102 |
柔毛霉素 叠氮化钠 ICR—191 链霉黑素 丝裂霉素 C 2,4,7 -三硝基- 9 -芴酮 4 -硝基-O-次苯二胺 4 -硝基喹啉-N-氧化物 甲基磺酸甲酯 2 -氨基芴 苯并(a)芘 |
6.0 1.5 1.0 0.25 0.5 0.20 20 0.5 1.0 10 1.0 |
- - - - - - - - - + + |
124 76 1640 inh inh 8377 2160 528 174 1742 337 |
3123 3 63 inh inh 8244 1599 292 23 6194 143 |
47 3000 185 inh inh 400 798 4220 2730 3026 937 |
592 188 0 2230 2772 16 0 287 6586 261 255 |
注:inh 表示抑菌。表中数值均已扣除溶剂对照回变菌落数。
8 大鼠肝微粒体酶的诱导和 S9 的制备
8.1 诱导
最广泛应用的大鼠肝微粒体酶的诱导剂是多氯联苯(PCB 混合物),选择健康雄性大鼠体重 200 g 左右,一次腹腔注射诱导剂,剂量为 500 mg/kg 体重。诱导剂溶于玉米油中,浓度为 200 mg/mL。苯巴比妥钠和β-萘黄酮结合也可做为诱导剂。
8.2 S9 制备
动物诱导后第五日断头处死。处死前 12 h 停止饮食,但可自由饮水。首先,用 75% 酒精消毒动物皮毛,剖开腹部。在无菌条件下,取出肝脏,去除肝脏的结缔组织,用冰浴的 0.15 mol/L 氯化钾溶液淋洗肝脏,放入盛有 0.15 mol/L 氯化钾溶液的烧杯里。按每克肝脏加入 0.15 mol/L 氯化钾溶液 3 mL。用电动匀浆器制成肝匀浆,再在低温高速离心机上,在 4 ℃ 条件下,以 9000 g 离心 10 min,取其上清液(S9)分装于塑料管中。每管装 2 mL ~3 mL。储存于液氮生物容器中或 - 80 ℃ 冰箱中备用。
上述全部操作均在冰水浴中和无菌条件下进行。制备肝 S9 所用一切手术器械、器皿等,均经灭菌消毒。S9 制备后,其活力需经诊断性诱变剂进行鉴定。
9 溶剂的选择
如果受试物为水溶性,可用灭菌蒸馏水作为溶剂;如为脂溶性,应选择对试验菌株毒性低且无致突变性的有机溶剂,常用的有二甲基亚砜(DMSO)、丙酮、95% 乙醇。一般操作中,为了减少误差和溶剂的影响,常按每皿使用剂量用同一溶剂配成不同的浓度,固定加入量为 100ml。
10 剂量的设计
决定受试物最高剂量的标准是对细菌的毒性及其溶解度。自发回变数的减少,背景菌变得清晰或被处理的培养物细菌存活数减少,都是毒性的标志。
对原料而言,一般最高剂量组可为 5 mg/皿。对产品而言,有杀菌作用的受试物,最高剂量可为最低抑菌浓度,无杀菌作用的受试物,最高剂量可为原液。受试物至少应设四个剂量组。每个剂量均做三个平行平板。
11 试验操作步骤
11.1 增菌培养
取营养肉汤培养基 5 mL,加入无菌试管中,将主平板或冷冻保存的菌株培养物接种于营养肉汤培养基内,37 ℃ 振荡(100 次/min)培养 10 h。该菌株培养物应每毫升不少于 1~2×109 活菌数。
11.2 平板掺入法
实验时,将含 0.5 mmol/L 组氨酸 -0.5 mmol/L 生物素溶液的顶层琼脂培养基 2.0 mL 分装于试管中,45 ℃ 水浴中保温,然后每管依次加入试验菌株增菌液 0.1 mL,受试物溶液 0.1 mL 和 S9 混合液 0.5 mL(需代谢活化时),充分混匀,迅速倾入底层琼脂平板上,转动平板,使之分布均匀。水平放置待冷凝固化后,倒置于 37 ℃ 培养箱里孵育 48 h。记数每皿回变菌落数。
实验中,除设受试物各剂量组外,还应同时设空白对照、溶剂对照、阳性诱变剂对照和无菌对照。
12 数据处理和结果判断
记录受试物各剂量组、空白对照(自发回变)、溶剂对照以及阳性诱变剂对照的每皿回变菌落数,并求平均值和标准差。
如果受试物的回变菌落数是溶剂对照回变菌落数的两倍或两倍以上,并呈剂量-反应关系者,则该受试物判定为致突变阳性。
受试物经上述四个试验菌株测定后,只要有一个试验菌株,无论在加 S9 或未加 S9 条件下为阳性,均可报告该受试物对鼠伤寒沙门氏菌为致突变阳性。如果受试物经四个试验菌株检测后,无论加 S9 和未加 S9 均为阴性,则可报告该受试物为致突变阴性。
13 试验报告
试验报告应包括以下内容:
(1)受试物名称、理化性状、配制方法、使用溶剂;
(2)试验菌株:所用试验菌株;
(3)代谢活化系统:所用诱导剂;
(4)试验方法:简述操作步骤,除受试物剂量分组外,还应说明空白对照、溶剂对照和阳性对照,
阳性结果判定标准;
(5)结果:以列表方式报告受试物的 Ames 实验结果(表 1);
(6)结论。
表 1 Ames 试验菌株的回变结果(平均值±标准差)
组别 |
剂量 (mg/皿) |
TA97 -( S9) +( S9) |
TA98 -( S9) +( S9) |
TA100 -( S9) +( S9) |
TA102 -( S9) +( S9) |
受试物 |
|||||
自发回变 |
|||||
溶剂对照 |
|||||
阳性物对照 |
Ames 试剂盒
北京汇智泰康医药技术有限公司针对 Ames 试验开发 Ames 试剂盒, 本试剂盒省去了培养基成分准备、诱导 S9 制备、菌株 鉴定、菌株培养等时间,可以直接使用,大大缩短了实验周期;试剂盒各成分均经过严格的质量检测,无杂菌污染,菌株特性与活菌数目以及诱导 S9 活性均符合 Ames 试验要求,实验结果准确、可靠、重现性高。Ames 试剂盒应用广泛,可进行食品与饮用水、化学品、洗涤剂、消毒剂、食品添加剂、药物残留、化妆品、容器与包装材料等多个方面的遗传毒理学检测。
| 包装盒 | 产品组成 | v5.1(4 菌) | V5.2(5 菌) | 使用说明 | 保存条件 | ||
| 规格 | 数量 | 规格 | 数量 | ||||
| A 盒 | 琼脂粉 Agar | 66 g | 1 | 80 g | 1 | 室温 | |
| 底层培养基 GS | 100 mL | 1 | 100 mL | 1 | 使用前混匀 | ||
| 氯化钠 | 3 g | 1 | 3 g | 1 | |||
| 2-氨基芴 | 1 mL | 1 | 1 mL | 1 | 200 μg/mL,使用前混匀 | ||
| 甲基磺酸甲酯 | 1 mL | 1 | 1 mL | 1 | 使用前加 1 mL 灭菌蒸馏水混匀, 浓度 10 μL/mL |
||
| 敌克松 | 1 mL | 1 | 1 mL | 1 | 500 μg/mL,使用前混匀 | ||
| 叠氮钠 | / | / | 0.5 mL | 1 | 15 μg/mL,使用前混匀 | ||
| 2-氨基蒽 | / | / | 0.5 mL | 1 | 20 μg/mL,使用前混匀 | ||
| S9 反应液42 mL | 42 mL | 1 |
42 mL | 1 | 使用前混匀 | ||
| 底层培养基 VS | 100 mL | 1 | 100 mL | 1 | 使用前混匀 | ||
| B 盒 | HB 溶液 | 2.5 mL | 1 | 2.5 mL | 1 | 使用前混匀 | - 80 ℃ 下长期保存, 可保存 6 个月。 - 20 ℃ 可短期保存 3 周。 请勿反复冻融。 |
| 1,8 -二羟基蒽醌 | 0.5 mL | 1 | 0.5 mL | 1 | 1 mg/mL,使用前混匀 | ||
| S9 混合物 | 1.4 mL | 5 | 1.4 mL | 6 | 使用前加 2.86 mL 冰冷灭菌蒸馏水复溶 |
||
| TA97 菌株 | 5.0 mL | 1 | 5.0 mL | 1 | 使用前混匀 | ||
| TA98 菌株 | 5.0 mL | 1 | 5.0 mL | 1 | |||
| TA100 菌株 | 5.0 mL | 1 | 5.0 mL | 1 | |||
| TA102 菌株 | 5.0 mL | 1 | 5.0 mL | 1 | |||
| TA1535 菌株 | 5.0 mL | 1 | 5.0 mL | 1 | |||
1. 诱导 S9 采用国际先进无菌冻干干燥工艺制成,实现了诱导 S9 酶活性的稳定保存,同时有效防止了细菌污染。实验时用 S9 反 应液溶解混匀。
2. 实验菌株采用先进工艺规模化制备,出厂前经过严格的质量检测,低温贮存条件确保了实验菌株的长期稳定性。实验时混 匀后即可直接使用,节省了菌株鉴定、活化处理以及菌液浓度调整等时间。
3. 实验阳性对照试剂种类覆盖整个 Ames 实验要求,在添加和不添加 S9 的情况下均可以诱导实验菌株呈现阳性反应。阳性对照 试剂采购自国际大品牌公司,按照 Ames 实验需求精准定量分 装,出厂前经过实验检测,阳性对照试剂的长期稳定性有质量 保证。
4. 底层培养基 VS、GS 以干粉形式提供,便于培养基长期稳定 保存。使用前只需添加蒸馏水灭菌处理即可,试剂瓶采用耐高 温材料,因此可以直接向试剂瓶中添加所需剂量的蒸馏水。
5. 顶层培养基 HB 冻干球采用先进无菌冻干干燥工艺制成,使用前需先用灭菌蒸馏水溶解,然后用 0.22 μm 滤膜过滤除菌。
试剂盒应用范围
本试剂盒应用范围非常广,可进行食品与饮用水、化学品、洗涤剂、消毒剂、食品添加剂、药物残留、化妆品、容器与包装 材料等遗传毒理学检测。
传统实验操作不足
周期长——培养基成分准备、诱导 S9 制备、菌株鉴定、菌株培养 等耗费大量时间。 稳定性差——杂菌污染、活菌数不符合要求、实验试剂配制不准 确等都会导致实验失败。
试剂盒优势
便捷——本试剂盒省去了培养基成分准备、诱导 S9 制备、菌株 鉴定、菌株培养等时间,可以直接使用,大大缩短了实验周期。
准确——本试剂盒各成分均经过严格的质量检测,无杂菌污染, 菌株特性与活菌数目以及诱导 S9 活性均符合 Ames 试验要求,实 验结果准确、可靠、重现性高。
稳定——本试剂盒稳定性强、易于运输和保存。
试剂盒使用操作流程
1. 实验器材、试剂准备:三角瓶、5 mL 或 15 mL 试管、100 μl 和 1000 μl 枪头、0.22 μm 滤膜、注射器、平皿、二甲基亚砜、灭菌 蒸馏水等;
2. 设置待测物剂量,配制各剂量无菌待测物溶液;
3. VS、GS 培养基加水溶解并灭菌,配制底层培养基;
4. HB 球加灭菌蒸馏水溶解,充分混匀,然后过滤除菌;
5. 实验当天配制顶层培养基,2 ml 分装,然后 45℃ 水浴保温;
6. 用无菌蒸馏水溶解 S9 复合物并配制 S9 反应混合液;
7. 开展 Ames 实验,将 2 mL 顶层培养基+ 100 μL 菌液+ 100 μL 待测 物或阳性底物+ 500 μL 10% S9 混合液混匀,倾倒于底层培养基(实验室温度低时倾倒的顶层培养基易冷凝,可将底层培养基 放置于 37 ℃ 培养箱一段时间,然后再倾倒顶层培养基);
8. 待顶层培养基冷凝后,将实验平皿放入 37 ℃ 培养箱,培养 48 h 后观察实验结果。
试验方法
试验方法主要是平板掺入法和预培养平板掺入法,具体操作如下:
1. 平板掺入法
a) 准备所需底层培养基平皿若干。
b) 融化顶层培养基分装于无菌小试管,每管 2 mL,在 45 ℃ 水 浴中保温。
c) 在保温的顶层培养基中依次加入测试菌株菌液 0.1 mL,混 匀;加受试物 0.05 mL~ 0.2 mL(一般加入 0.1 mL。需活化时 另外再加入 10 % S9 反应混合液 0.5 mL),再混匀,然后迅速倾入底层培养基上。转动平皿,使顶层培养基均匀分布在底层上,平放固化,37 ℃ 培养 48 h 观察结果。
d) 另做一阳性对照、溶剂对照和未处理对照。阳性对照不加 受试物,只加标准诱变剂(即试剂盒阳性对照试剂,见表 2);溶剂对照加除受试物和标准诱变剂以外的所有试剂, 如溶剂二甲基亚砜等(光谱纯或分析纯);未处理对照只 在培养基上加菌液;其他方法同上。
2. 预培养平板掺入法 预培养对于某些受试物可取得较好效果。因此可根据情况确定 是否进行预培养。在加入顶层琼脂前,先进行以下预培养步
骤:在试验中,将受试物(需活化时另加入 10% S9 反应混合 液)和菌液,在 37 ℃ 中培养 20 min,或在 30 ℃ 中培养 30 min,然 后再加 2 mL 顶层琼脂,其他同上述平板掺入法。
试验设计及受试物的特殊处理
1) 剂量设计 决定受试物最高剂量的原则是受试物对试验菌株的毒性和受试物的溶解度。对于纯的化学物质,一般最低剂量为每平皿 0.2 μg,最高剂量为 5 mg,或溶解度允许,或饱和浓度,或对细菌产生最小毒性浓度。对于毒性很低、摄入量很大的定型产品,可根据其溶解度和对细菌的毒性采用可能的最大剂量。每 种受试物在允许最高剂量下设 4 个(含 4 个)以上剂量,每剂量间隔不超过 5 倍,每个剂量应做三个平皿。
2) 溶剂 溶剂可选用水、二甲基亚砜或其他溶剂(溶剂剂量应限定在毒性剂量以下。以二甲基亚砜为例,平板掺入法每皿不超过 0.1 mL 溶剂;预培养平板掺入法每皿不超过 0.01 mL 溶剂), 无论选用什么溶剂均应无诱变性。
3) 对照组的设置 试验应同时设有阳性物对照组、溶剂对照组和未处理对照,均 包括加 S9 和不加 S9 两种情况。
4) 受试物的特殊处理 若遇特殊受试物作非常规处理时应在报告中说明。对以下几种情况可作如下处理:
a) 含组氨酸受试物:根据食品中测得的组氨酸含量若能诱发 回复突变率的增高可加设组氨酸平行对照组;或将检品经 XAD-II 树脂柱过滤洗脱预处理。
b) 食品包装材料及其制品成分:根据材料或制品的组成成 分,可分别采取过筛抽提、蒸发残渣等技术处理。
c) 挥发性受试物:可采用真空干燥器处理等方法。
d) 天然植物材料:可按植物化学方法制备粗制品或纯制品。
结果的判定
以直接计数培养基上长出回变菌落数的多少而定,如在背景生 长良好条件下,受试物组回变菌落数是溶剂对照回变菌落数的 两倍或两倍以上,并有剂量反应关系或至少某一测试点有可重 复的并有统计学意义的阳性反应,即可认为该受试物诱变试验 阳性。受试物经上述四个试验菌株测定后,只要有一个试验菌 株,无论在加 S9 或未加 S9 条件下为阳性,均可报告该受试物对 鼠伤寒沙门氏菌为致突变阳性。如果受试物经四个试验菌株检 测后,无论加 S9 和未加 S9 均为阴性,则可报告该受试物为致突 变阴性。
Ames 实验报道文献举例
广东省疾病预防控制中心通过 Ames 试验发现部分染发剂引起试验 菌株 TA97、TA98、TA100 回变率明显升高,提示部分染发类 产品具有致突变作用,可对健康产生危害。何冬梅等、中 国 卫 生检验杂志 2007,17,(11)。
人参与女贞子是临床上常见的有一定抗肿瘤效果的补益中药,在 Ames 试验中人参能抑制二氨基芴引起的 TA98 菌株回变菌落数的增加;女贞子能抑制叠氮钠引起的 TA100 菌株回变菌落数的增加,分别表现出抗移码型突变和抗碱基置换型突变的作用。倪娅等、中国保健 2009,17,(17)。生活饮用水经投加二氧化氯处理后对水中石油类污染物具有较 强的去除作用,可使水中有毒有害有致癌性的物质氧化降解为 毒性较小、无致癌作用的小分子物质,并且致突变活性明显降低,Ames 值由阳性转为阴性。高庆然等、工业用水与废水 2001,6。
喹烯酮是我国自主研发的喹噁啉类一类新兽药,作为抗菌促生 长剂用于猪饲料中, Ames 试验表明喹烯酮对 TA97、TA98、 TA100 和 TA1537 加和不加 S9 在一定剂量下均为阳性。结果提 示,喹烯酮存在一定致突变毒性,应制定最高残留限量。张伟 等、毒理学杂志 2007,04。
Ames 试验表明煤和液化石油气(LPG)燃烧颗粒物均具有很强 的直接和间接致突变作用,主要致突变作用来源于硝基和胺基多环芳烃,两种颗粒物同时存在可加大致癌风险。闫洪涛等、 中国公共卫生 2007,04。
烷基酚聚氧乙烯醚(APES)是一大类表面活性剂家族,广泛 用于家庭和工业的清洁产品,烷基酚类化合物是其降解产物, 其中对甲基苯酚、2,6 -二甲基苯酚、4 -乙基苯酚、4 -辛基苯酚、对壬基苯酚、4 -硝基苯酚、2 -氯苯酚、1,3 -二氯苯酚、2,4 -二氯 苯酚、2,6 -二氯苯酚、三氯苯酚和 2,3,5,6 -四氯苯酚 12 种化合物 的 Ames 试验表明除 2,4 - 二氯苯酚未诱发各菌株的阳性反应外,其余 11 种待测物均诱发了阳性反应, 说明这 11 种苯酚类化 合物均具有致突变性。杨丽等、东北师大学报(自然科学版)
2003,01。
重组葡糖激酶作为一种生物技术药物具有明显的溶栓和抗凝效果,Ames 实验结果显示重组葡糖激酶对试验菌株 TA97 、TA98、TA100 和 TA102 无诱发回变作用。刘永学等、癌变·畸变·突变 2004,9。
常见问题及原因分析
1、自发回变数显著低于标准 原因:a. 试剂盒保存条件不合适,菌株失活或营养成分降解;b. 培养基配制操作过程中组氨酸、生物素添加量低;c. 操作过程中添加菌液时顶层培养基温度过高;
2、自发回变数显著高于标准 原因:a. 培养基配制操作过程中组氨酸、生物素添加量高;b. 培养皿经环氧乙烷消毒不彻底或环氧乙烷有残留;
3、阳性底物诱变菌落数偏离标准范围 原因:a. 阳性底物溶解不彻底或未充分混匀;b. 阳性底物添加量不准确;c. 试剂盒保存条件不合适或过期,阳性底物降解或 S9 失活;d. 操作过程中添加菌液时顶层培养基温度过高;
4、待测物诱变菌落数非常低或没有菌落 原因:a. 待测物或待测物溶剂对细菌生长有毒性;b. 试剂盒保存条件不合适或过期,阳性底物降解或 S9 失活; c. 操作过程中添加菌液时顶层培养基温度过高;
5、菌落分布不均匀,集中偏向一侧。原因: 倒底层或顶层培养基时平皿未水平放置;
6、顶层或底层培养基凝固不充分或滑出平皿 原因:a. 顶层或底层培养基中琼脂粉含量低;b. 顶层培养基中加入的溶剂或待测物酸化,导致凝胶不充分;
7、如何判断 Ames 实验结果是否为假阳性 将经受试物和阳性对照物处理的 Ames 菌落进行增菌培养后接种于无组氨酸的培养基上, 观察比较细菌的生长情况。如果经受试 物处理的菌株不能生长在无组氨酸的培养基中, 而经阳性对照物处 理的菌株则可以生长在无组氨酸的培养基上, 则说明经受试物处理 的菌株没有发生突变,试验中所观察到的菌落数增加是假阳性。


你可能喜欢