MALDI-TOF-MS最初用于等分试样(1μL或更少)样品的质谱鉴定,用于检查肽的纯度或PMF。大批量的样品测定,往往使用Edman降解法测序或ESI-MS,如四极(Q)-TOF-MS 质谱。做出以上选择的原因,主要是因为MALDI技术进行分析,上样量不能超过0.5μL。这种样品制备方法极大地限制了MALDI技术检测的整体灵敏度,并且还限制了可以分析的肽浓度,因为肽和基质共结晶过程的质量对于检测的灵敏度和准确性都非常重要。MALDI技术通常将等体积的样品和MALDI基质溶液混合,将肽混合物干燥,连续洗涤使用预制型的薄层基质。该方法为精确和灵敏的MALDI检测创造了最佳条件。然而,这种样品制备方法制备的样品不能承受激光辐射,会被迅速漂洗。因此,该方法不适用于PSD光谱的蛋白质谱鉴定,因为PSD光谱法通常每个片段质量范围需要多达100甚至以上次数反复的激光辐射。
如果在分析之前,使用小型吸附柱对较大体积的肽混合物进行浓缩,抑或通过向肽混合物中添加少量反相色谱珠的方式进行批量吸附。而进行批量吸附,只需要将磁珠吸附到的肽混合物进行洗涤,即可获得肽混合物,然后转移至上样处并干燥即可。这种批量吸附浓缩的方法(i)可以将肽浓缩几个数量级,(ii)可以用作纯化步骤,并且(iii)可以形成形成微晶的条件,我们前面提了这些微晶可以应对大量的激光辐射,从而为PSD分析创造条件。 这一方法,可以实现少于200摩尔的肽/ μL的样品也可用于PSD法进行分析。
通过降低样品表面积是另一个增加检测灵敏度的方法,最佳的情况下,样品的表面积可以小于激光束的直径。要实现这一要求,可以通过在上样板上增加疏水性表面(例如,特氟隆)的方法来实现。当样品液滴放置在加样板上时,肽在蒸发的过程中浓缩成较小的体积。通过这一改进,可以实现亚摩尔级别蛋白样品的质谱鉴定。目前,与寡核苷酸检测类似,如果在疏水环境中创建一个小的亲水位点,以避免肽基质在疏水板表面的随机结晶。理想条件下,样品会在这个小亲水位点处结晶,从而提高整体测量的灵敏度。处理少量样品时,另一个引起注意的问题是角蛋白的污染,这种蛋白主要来自人类或绵羊的汗液。只需要采取简单的预防措施,例如使用新鲜制作的缓冲液和溶液(凝胶溶液,电泳缓冲液染色溶液,消化缓冲液)以及限制凝胶在空气中的暴露时间(例如,在染色过程中),即可避免该问题。
在MALDI-MS方法中,蛋白质胶样质谱鉴定过程中,多肽的回收是一个问题。如下图所示,将胶样中同样的20 ng兔骨骼肌肌动蛋白用不同的染色法进行染色:常规银染色(无戊二醛)与锌-咪唑锌阴性染色法。染色后,用胰蛋白酶在凝胶中对蛋白质进行消化,磁珠法对样品进行浓缩,用MALDI-MS进行蛋白质谱鉴定。结果发现,与阴性染色的蛋白质相比,蛋白质的银染色导致胰蛋白酶肽的回收率降低(比较图中左右两边肽的S / N比率)。该影响可通过去除蛋白质染色过程中银染试剂的方式消除。
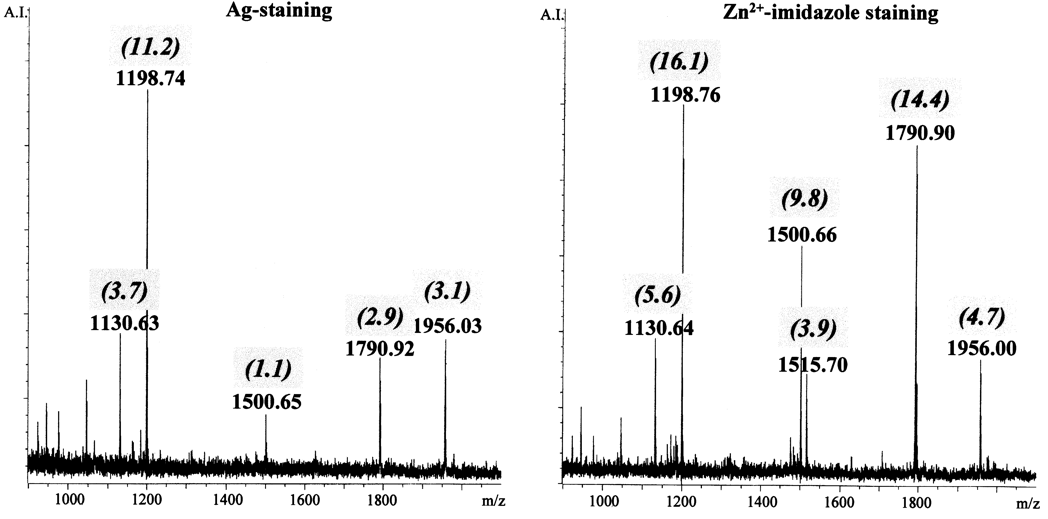
图注:20 ng (500 fmol)兔骨骼肌肌动蛋白经胰酶消化后,MALDI技术分析得到的肽指纹图谱。使用1-D SDS PAGE胶分离后的目标蛋白分别使用:无戊二醛的银染法(图左)和Zn2+-imidazol染色法(图右)进行染色。切胶后用胰蛋白酶进行消化,使用多孔 R2磁珠进行浓缩,DE-MALDI-RETOF-MS分析,得到胰蛋白酶肌动蛋白肽的质量及其S/N(斜体)比率。
本文由百泰派克生物科技整理编辑。未经许可,不得转载。
北京百泰派克公司采用高分辨率质谱平台技术,包括Thermo Fisher的Q Exactive质谱仪,LTQ Orbitrap Velos质谱仪,以及AB SCIEX的6500 Q TRAP质谱仪,结合 Nano-LC高通量液相色谱技术,能够对SDS-PAGE蛋白条带、2D蛋白胶点等样品中的蛋白质进行高效精准鉴定。胶条、胶点蛋白质谱鉴定服务可保证100%的鉴定率,否则不收任何费用。
文献参考:Protein identification methods in proteomics. Electrophoresis, 2000.
如果在分析之前,使用小型吸附柱对较大体积的肽混合物进行浓缩,抑或通过向肽混合物中添加少量反相色谱珠的方式进行批量吸附。而进行批量吸附,只需要将磁珠吸附到的肽混合物进行洗涤,即可获得肽混合物,然后转移至上样处并干燥即可。这种批量吸附浓缩的方法(i)可以将肽浓缩几个数量级,(ii)可以用作纯化步骤,并且(iii)可以形成形成微晶的条件,我们前面提了这些微晶可以应对大量的激光辐射,从而为PSD分析创造条件。 这一方法,可以实现少于200摩尔的肽/ μL的样品也可用于PSD法进行分析。
通过降低样品表面积是另一个增加检测灵敏度的方法,最佳的情况下,样品的表面积可以小于激光束的直径。要实现这一要求,可以通过在上样板上增加疏水性表面(例如,特氟隆)的方法来实现。当样品液滴放置在加样板上时,肽在蒸发的过程中浓缩成较小的体积。通过这一改进,可以实现亚摩尔级别蛋白样品的质谱鉴定。目前,与寡核苷酸检测类似,如果在疏水环境中创建一个小的亲水位点,以避免肽基质在疏水板表面的随机结晶。理想条件下,样品会在这个小亲水位点处结晶,从而提高整体测量的灵敏度。处理少量样品时,另一个引起注意的问题是角蛋白的污染,这种蛋白主要来自人类或绵羊的汗液。只需要采取简单的预防措施,例如使用新鲜制作的缓冲液和溶液(凝胶溶液,电泳缓冲液染色溶液,消化缓冲液)以及限制凝胶在空气中的暴露时间(例如,在染色过程中),即可避免该问题。
在MALDI-MS方法中,蛋白质胶样质谱鉴定过程中,多肽的回收是一个问题。如下图所示,将胶样中同样的20 ng兔骨骼肌肌动蛋白用不同的染色法进行染色:常规银染色(无戊二醛)与锌-咪唑锌阴性染色法。染色后,用胰蛋白酶在凝胶中对蛋白质进行消化,磁珠法对样品进行浓缩,用MALDI-MS进行蛋白质谱鉴定。结果发现,与阴性染色的蛋白质相比,蛋白质的银染色导致胰蛋白酶肽的回收率降低(比较图中左右两边肽的S / N比率)。该影响可通过去除蛋白质染色过程中银染试剂的方式消除。

图注:20 ng (500 fmol)兔骨骼肌肌动蛋白经胰酶消化后,MALDI技术分析得到的肽指纹图谱。使用1-D SDS PAGE胶分离后的目标蛋白分别使用:无戊二醛的银染法(图左)和Zn2+-imidazol染色法(图右)进行染色。切胶后用胰蛋白酶进行消化,使用多孔 R2磁珠进行浓缩,DE-MALDI-RETOF-MS分析,得到胰蛋白酶肌动蛋白肽的质量及其S/N(斜体)比率。
本文由百泰派克生物科技整理编辑。未经许可,不得转载。
北京百泰派克公司采用高分辨率质谱平台技术,包括Thermo Fisher的Q Exactive质谱仪,LTQ Orbitrap Velos质谱仪,以及AB SCIEX的6500 Q TRAP质谱仪,结合 Nano-LC高通量液相色谱技术,能够对SDS-PAGE蛋白条带、2D蛋白胶点等样品中的蛋白质进行高效精准鉴定。胶条、胶点蛋白质谱鉴定服务可保证100%的鉴定率,否则不收任何费用。
文献参考:Protein identification methods in proteomics. Electrophoresis, 2000.


你可能喜欢